Mantener un sistema a temperatura constante: el proceso isotérmico
En la física, cuando la temperatura se mantiene constante como otras cantidades cambio, usted tiene lo que se llama un sistema isotérmico. El aparato notable en la primera figura muestra un ejemplo de un sistema isotérmico.
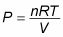
Está especialmente diseñado para mantener la temperatura de la constante de los gases cerrado, incluso cuando se eleva el pistón. Cuando se aplica calor a este sistema, el pistón sube o baja lentamente de una manera tal como para mantener el producto de la presión veces el volumen constante. Porque PV = nRT, la temperatura se mantiene constante también. (Recuerda que n es el número de moles de gas que se mantiene constante, y R es la constante de los gases.)
¿Cómo se ve el trabajo como como los cambios de volumen? Porque PV = nRT, la relación entre P y V es
Usted puede ver esta ecuación graficada en la segunda figura, que muestra el trabajo realizado como el área sombreada debajo de la curva. Pero, ¿qué diablos es esa área?

El trabajo realizado en un proceso isotérmico está dada por la siguiente ecuación, donde ln es el logaritmo natural (ln en tu calculadora), R es la constante de los gases # 8232;
VF es el volumen final, y Vyo es el volumen inicial:
Debido a que la temperatura se mantiene constante en un proceso isotérmico y debido a la energía interna de un gas ideal es igual a (3/2)nRT, la energía interna no cambia. Por lo tanto, usted encuentra que el calor es igual al trabajo realizado por el sistema:
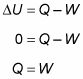
Si te sumerges el cilindro que se ve en la primera figura en un baño de calor, ¿qué pasaría? El calor, Q, fluiría dentro del aparato, y porque la temperatura del gas se mantiene constante, todo lo que el calor se convertiría en el trabajo realizado por el sistema.
Digamos que usted tiene un mol de helio para jugar con en un día lluvioso de la temperatura de 20 grados centígrados, y para la diversión decide ampliarlo desde Vyo = 0,010 m3 a # 8232-VF = 0,020 m3. ¿Cuál es el trabajo realizado por el gas en la expansión? Todo lo que tienes que hacer es conectar los números:

El gas hace 1.690 julios de trabajo. El cambio del gas en energía interna es 0 julios, como siempre en un proceso isotérmico. Y por eso Q = W, el calor añadido al gas es también igual a 1.690 julios.
He aquí otro ejemplo. Di que te dan 2,0 moles de gas de hidrógeno a una temperatura de 600 grados Kelvin para su cumpleaños. Ampliar el gas de un volumen de 0,05 metros cúbicos a 0.10 metros isotérmicamente, uno se pregunta cuánto trabajo hace el gas, por lo que salga en el portapapeles. El trabajo realizado por un gas ideal durante la expansión isotérmica es
La conexión de los números y hacer las matemáticas le da

Así que el gas hace 6.900 julios de trabajo durante su expansión.
¿Qué pasa con el cambio en la energía interna del gas? Usted sabe que el cambio en la energía interna es

la expansión isotérmica.






