Cómo predecir la solubilidad basado en la temperatura
El aumento de temperatura aumenta los efectos de entropía en un sistema. Debido a que la entropía de un soluto se incrementa generalmente cuando se disuelve, el aumento de temperatura por lo general aumenta la solubilidad - para solutos sólidos y líquidos, de todos modos. Otra forma de entender el efecto de la temperatura sobre la solubilidad es pensar en el calor como un reactivo en la reacción de disolución:
El calor es normalmente absorbido en partículas de soluto cuando un soluto se disuelve. El aumento de temperatura corresponde a calor añadido. Así que por el aumento de la temperatura, que proporciona un reactivo necesario en la reacción de disolución. (En los casos raros donde el calor comunicados de disolución, el aumento de la temperatura puede disminuir la solubilidad.)
Solutos gaseosos comportan de manera diferente de solutos sólidos o líquidos con respecto a la temperatura. El aumento de la temperatura tiende a disminuir la solubilidad del gas en el líquido. Para entender este patrón, revisar el concepto de presión de vapor. El aumento de temperatura aumenta la presión de vapor porque el calor añadido aumenta la energía cinética de las partículas en solución. Con energía añadida, estas partículas tienen más posibilidades de liberarse de las fuerzas intermoleculares que los mantienen en solución. Un clásico ejemplo de la vida real del efecto de la temperatura sobre la solubilidad del gas es carbonatada soda. ¿Qué va plana (pierde su gas disuelto dióxido de carbono) con mayor rapidez: la soda caliente o soda fría?
La comparación de la solubilidad del gas en líquidos con el concepto de presión de vapor destaca otro patrón importante: El aumento de la presión aumenta la solubilidad de un gas en un líquido. Así como las altas presiones hacen que sea más difícil para las moléculas líquidas para escapar en la fase de vapor-vivienda superficie, altas presiones inhiben el escape de los gases disueltos en el disolvente. Enrique'ley s resume esta relación entre la presión y la solubilidad del gas:
Solubilidad = Constante x Presión
La "constante" en la ley de Henry es Enrique's constante, y su valor depende del gas, disolvente, y la temperatura. Una forma particularmente útil de la ley de Henry se relaciona la solubilidad (S) y la presión (P) entre dos estados diferentes:
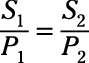
De acuerdo con esta relación, triplicando la presión triplica la solubilidad del gas.
Try un ejemplo. La constante de Henry para el gas nitrógeno (N2) En agua a 293 K es
La presión parcial de nitrógeno en el aire a nivel del mar es 0,78 atm. ¿Qué es la solubilidad del N2 en un vaso de agua a 20 grados centígrados que se sienta en una mesa de café dentro de una casa en la playa?
Este problema requiere la aplicación directa de la ley de Henry. El vaso de agua está a 20 grados centígrados, lo que equivale a 293 K (sólo tiene que añadir 273 a cualquier temperatura Celsius a obtener el equivalente Kelvin). Debido a que el vidrio se sienta dentro de una casa en la playa, se puede asumir que el vaso está a nivel del mar. Así que usted puede utilizar los valores previstos para la presión constante y el parcial de Enrique de N2:
Por lo tanto, la solubilidad de N2 es






