El mantenimiento de un sistema al calor constante: el proceso adiabático
En la física, cuando se tiene un proceso en el que fluye sin calor desde o hacia el sistema, ha llamado proceso adiabático. La primera figura muestra un ejemplo de un proceso adiabático: un cilindro rodeado por un material aislante. El aislamiento impide que el calor fluya dentro o fuera del sistema, por lo que cualquier cambio en el sistema es adiabático.
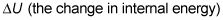
Examinando el trabajo realizado durante un proceso adiabático, se puede decir Q = 0, por lo
es igual -W.
El signo menos se encuentra en frente de la W porque la energía para hacer el trabajo proviene del propio sistema, por lo que haciendo los resultados del trabajo en una energía interna más baja.
Debido a que la energía interna de un gas ideal es U = (3/2)nRT, el trabajo realizado es el siguiente:
dónde TF representa la temperatura final y Tyo representa la temperatura inicial. Así que si el gas funciona, que el trabajo viene de un cambio en la temperatura - si la temperatura baja, el gas no funciona en su entorno.
Usted puede ver lo que un gráfico de la presión en función del volumen se ve como un proceso adiabático en la segunda figura. La curva adiabática en esta figura, llamada adiabática, es diferente de las curvas isotérmicas, llamado isotermas. El trabajo se realiza cuando el calor total en el sistema es constante es el área sombreada bajo la curva.
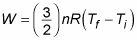
En expansión adiabática o compresión, se puede relacionar la presión inicial y volumen a la presión final y el volumen de esta manera:

constante la presión dividida por la capacidad de calor específico de un gas ideal a volumen constante (calor específico es la medida de la cantidad de calor que un objeto puede contener):
¿Cómo se puede encontrar esas capacidades caloríficas específicas? Eso viene a continuación.
Para averiguar la capacidad de calor específico, es necesario relacionar el calor, Q, y la temperatura, T. Por lo general, utiliza la fórmula

representa el cambio en la temperatura.
Para los gases, sin embargo, es más fácil hablar en términos de molar calor específico, que viene dada por C y cuyas unidades son julios / mol-kelvin
Con capacidad de calor específico molar, se utiliza un número de moles, n, en lugar de # 8232-la masa, m:
Para resolver C, usted debe tener en cuenta dos cantidades diferentes, CP (presión constante) y CV (volumen constante). Resuelto por Q, la primera ley de la termodinámica establece que

el cambio en la energía interna de un gas ideal, es
Por Consiguiente, Q a volumen constante es la siguiente:
Ahora mira el calor a presión constante (QP). A presión constante, trabajo (W) es igual a

Por lo tanto, aquí está Q a presión constante:
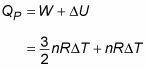
Así que, ¿cómo conseguir los calores específicos molares de esto? Usted ha decidido que
que relaciona el intercambio de calor, Q, a la diferencia de temperatura,
a través de la capacidad de calor específico molar, C. Esta ecuación es válida para el intercambio de calor a volumen constante, QV, por lo que escribes
dónde CV es el calor específico a volumen constante. Usted ya tiene una expresión para QV, por lo que puede sustituir en la ecuación anterior:
A continuación, puede dividir ambos lados por
para obtener el calor específico a volumen constante:
Si repite esto para el calor específico a presión constante, se obtiene
Ahora usted tiene la capacidad de calor específico molar de un gas ideal.
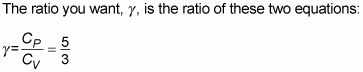
Para un gas ideal, se puede conectar la presión y el volumen en dos puntos a lo largo de una curva adiabática de esta manera:






