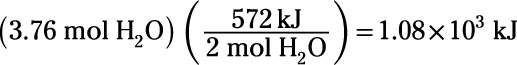Cómo calcular las reacciones endotérmicas y exotérmicas
Mediante el cálculo de la variación de entalpía de una reacción química, se puede determinar si la reacción es endotérmica o exotérmica. Las reacciones químicas transforman la materia y la energía. Aunque las ecuaciones químicas generalmente enumeran sólo los componentes de la materia de una reacción, también se puede considerar la energía térmica como reactivo o producto. Cuando los químicos están interesados en el flujo de calor durante una reacción (y cuando la reacción se realiza a presión constante), se puede indicar una variación de entalpía
a la derecha de la ecuación de reacción. A presión constante, el flujo de calor es igual a cambio de entalpía:
Si el cambio de entalpía enumerado para una reacción es negativa, entonces esa reacción libera calor a medida que avanza - la reacción es exotérmico (exo = Salida). Si el cambio de entalpía de la lista para la reacción es positiva, entonces que la reacción absorbe el calor a medida que avanza - la reacción es endotérmica (endo- = In). En otras palabras, las reacciones exotérmicas liberan calor como un producto, y reacciones endotérmicas consumen calor como un reactivo.
El signo de la
le dice la dirección del flujo de calor, pero ¿qué pasa con la magnitud? Los coeficientes de una reacción química representan equivalentes molares, por lo que el valor indicado para la
se refiere a la variación de entalpía para un equivalente molar de la reacción. He aquí un ejemplo:
Esta ecuación describe la reacción de la combustión de metano, una reacción que se podría esperar para liberar calor. El cambio de entalpía para la reacción enumerados confirma esta expectativa: Para cada mol de metano que se quema, 802 kJ de calor se libera. La reacción es altamente exotérmica. Sobre la base de la estequiometría de la ecuación, también se puede decir que 802 kJ de calor se libera por cada 2 moles de agua producida.
Así que los cambios de entalpía de reacción (o reacción "calores") son una forma útil de medir o predecir el cambio químico. Pero son tan útiles para hacer frente a los cambios físicos, como la congelación y fusión, evaporación y condensación, y otros. Por ejemplo, el agua (como la mayoría de las sustancias) absorbe el calor ya que se derrite (o fusibles) Y ya que se evapora. Aquí están las entalpías molares de esos cambios:
Entalpía molar de fusión:
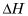
Entalpía molar de vaporización:
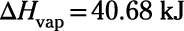
El mismo tipo de reglas se aplican a entalpía cambios enumerados por cambios químicos y cambios físicos. He aquí un resumen de las reglas que se aplican a los dos:
El calor absorbido o liberado por un proceso es proporcional a los moles de sustancia que se someten a ese proceso. Por ejemplo, 2 moles de combustión de la liberación de metano dos veces tanto calor como 1 mol de la combustión de metano.
Ejecución de un proceso a la inversa produce el flujo de calor de la misma magnitud pero de signo opuesto como ejecutar el proceso. Por ejemplo, la congelación 1 mol de agua libera la misma cantidad de calor que se absorbe cuando 1 mol de agua se derrite.
Try un ejemplo: aquí es una ecuación química balanceada para la oxidación de gas hidrógeno para formar agua líquida, junto con el cambio de entalpía correspondiente:
¿Cuánta energía eléctrica se deben gastar para realizar la electrólisis de 3,76 mol de agua líquida, convertir ese agua en hidrógeno y oxígeno gaseoso?
En primer lugar, reconocer que el cambio de entalpía dado es para el reverso de la reacción de electrólisis, por lo que debe invertir su signo de -572 kJ a 572 kJ. En segundo lugar, recuerdan que calores de reacción es proporcional a la cantidad de sustancia que reacciona (2 mol de H2O en este caso), por lo que el cálculo es