Cómo medir el cambio de entalpía utilizando la ley de Hess
Para el químico, Hess'ley s es una herramienta valiosa para la disección de flujo de calor en complicadas, reacciones de varios pasos. Para el estudiante de química confundido o descontentos, la ley de Hess es un soplo de aire fresco. En esencia, la ley confirma que el calor se comporta de la manera que nos gustaría que se comporte: predecible.
Imagine que el producto de una reacción sirve como reactivo para otra reacción. Ahora imagina que el producto de la segunda reacción sirve como reactivo para la tercera reacción. Lo que tenemos es un conjunto de reacciones acopladas, conectados en serie como los vagones de un tren:
Por Consiguiente,
Usted puede pensar en estas tres reacciones que suman una gran reacción
¿Cuál es el cambio total de entalpía asociado con esta reacción
Aquí está la buena noticia:
Cambios de entalpía son aditivos. Pero la buena noticia es aún mejor. Imagínese que usted está tratando de averiguar el cambio total de entalpía para la siguiente reacción de varios pasos:
Aquí hay una arruga: Por razones técnicas, no se puede medir este cambio de entalpía
directamente sino que debe calcularlo a partir de valores tabulados para
y
No hay problema, ¿verdad? Sólo tiene que mirar hacia arriba los valores tabulados y añadirlos. Pero aquí hay otra arruga: cuando usted mira para arriba los valores tabulados, se encuentra la siguiente:
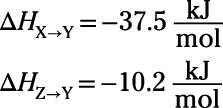
¡Oh! Necesitas
pero estás sólo se ha proporcionado
Relájese. El cambio de entalpía para una reacción tiene la misma magnitud y el signo opuesto como la reacción inversa. Así que si
después
Es realmente así de simple:
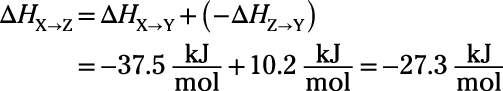
Gracias a Hess.
Try un ejemplo. Calcular la entalpía de reacción para la reacción siguiente:
Utilice los siguientes datos:
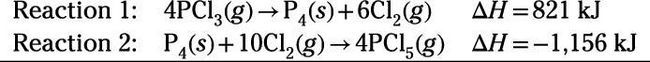
Entalpías de reacción se dan para dos reacciones. Su tarea es manipular y añadir las reacciones 1 y 2 por lo que la suma es equivalente a la reacción objetivo. En primer lugar, revertir reacciones 1 y 2 para obtener Reacciones
y
y añadir las dos reacciones. Especies idénticas que aparecen en los lados opuestos de las ecuaciones se cancelan (como ocurre con especies P4 y Cl2):
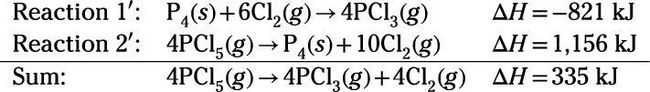
Por último, dividir la suma por 4 para obtener la ecuación de reacción de destino:
Por lo tanto, la entalpía de reacción para la reacción es 83,8 kJ.






