Calcular reactivos limitantes, el exceso de reactivos y productos en las reacciones químicas
En las reacciones químicas de la vida real, no todos los reactivos presentes convertir en producto. Más típicamente, un reactivo se utiliza por completo, y otros se quedan en exceso, quizá para reaccionar otro día. El reactivo que se utiliza hasta es el reactivo limitante.
Los químicos necesitan saber qué reactivo se agotarán primero, debido a que la información les permite deducir la cantidad de producto y el exceso de reactivo que pueden esperar, en base a la cantidad de reactivo limitante que han puesto en la reacción.
En cualquier reacción química, sólo tiene que elegir uno de reactivos como candidato para el reactivo limitante, calcular el número de moles de reactivo que usted tiene, y luego calcular cuántos gramos del otro reactivo que había necesidad de reaccionar tanto a la terminación. Usted descubrirá una de dos cosas. O usted tiene un exceso del primer reactivo, o si tiene un exceso del segundo reactivo. El único que tiene en exceso es la el exceso de reactivo. El que no está en exceso es la reactivo limitante.
Aquí's un ejemplo. Digamos que usted está llevando a cabo un experimento en el amoniaco reacciona con el oxígeno para producir monóxido de nitrógeno y el agua líquida:
Con el fin de encontrar los reactivos limitantes, el exceso de reactivos y productos en esta reacción, es necesario hacer lo siguiente:
Equilibrar la ecuación.
Determinar el reactivo limitante si 100 g de cada reactivo están presentes al comienzo de la reacción.
Identificar el exceso de reactivo, así como la forma permanecerán muchos gramos de el exceso de reactivo cuando la reacción llega a su finalización.
Calcular cómo se producirán muchos gramos de cada producto si la reacción se completa.
Así pues, aquí está la solución:
Equilibrar la ecuación.
Antes de hacer cualquier otra cosa, debe tener una ecuación de reacción equilibrada. No pierda el buen pensamiento en una ecuación desequilibrada. La forma equilibrada de la ecuación dada es

Dos candidatos, NH3 y O2, competir por el estatus de reactivo limitante. Se empieza con 100 g de cada uno, que corresponde a un número de moles de cada uno. Por otra parte, se puede decir de los coeficientes de la ecuación ajustada de esta reacción requiere 4 moles de amoniaco por cada 5 moles de gas oxígeno.
Determinar el reactivo limitante si 100 g de amoníaco y 100 g de oxígeno están presentes al comienzo de la reacción.
Para encontrar el reactivo limitante, sólo hay que realizar una masa-masa (gramos a gramo) cálculo de un reactivo a la otra. Esto le permite ver qué reactivo se agote primero. Puede comenzar con cualquiera de los reactivos y convertir a la masa de la otra. En este ejemplo, vamos a empezar con amoniaco:
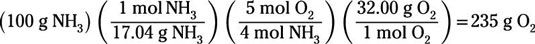
El cálculo revela que se necesitaría 235 g de gas oxígeno para reaccionar completamente con 100 g de amoníaco. Pero usted tiene sólo 100 g de oxígeno. Usted se quedará sin oxígeno antes de ejecutar fuera de amoníaco, por lo el oxígeno es el reactivo limitante.
Identificar el exceso de reactivo, así como la forma permanecerán muchos gramos de el exceso de reactivo cuando la reacción llega a su finalización.
Para calcular cuántos gramos de amoniaco se dejó al final de la reacción, se supone que todos los 100 g de oxígeno reacciona:
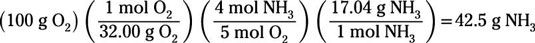
Este cálculo muestra que 42,5 g del original 100 g de amoniaco reacciona antes de que se gastó el reactivo limitante. Por lo tanto, el exceso de reactivo es el amoníaco, y 57,5 g de amoníaco permanecerá cuando la reacción llega a su cumplimiento (justo restar 42,5 por 100).
Cálculo de cómo se producen muchos gramos de monóxido de nitrógeno y agua si la reacción se completa.
Este problema se pregunta cuánto de un producto se produce. Para este cálculo, se debe comenzar con el reactivo limitante. Para determinar los gramos de monóxido de nitrógeno que se generan por la reacción completa de oxígeno, comenzar con la suposición de que todos los 100 g del oxígeno reacciona:

Por lo tanto, Se produjo 75 g de monóxido de nitrógeno.
Una vez más, se supone que todos los 100 g de oxígeno reaccionan con el fin de determinar cuántos gramos de agua se producen:
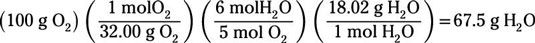
Usted encontrará que Se producirá 67.5g de agua.




