¿Cómo resolver ecuaciones usando partículas, volumen y conversión en masa
Verdadero reactivos (reactivos) tienden a ser medido en unidades de masa o volumen. Productos reales se miden de la misma manera. Así que hay que ser capaz de utilizar mol-masa, mole volumen, y los factores de conversión mol de partículas para traducir entre estos diferentes dialectos de conteo.
La figura resume la interrelación entre todas estas cosas y sirve como un diagrama de flujo para la solución de problemas. Todos los caminos conducen hacia y desde el topo.
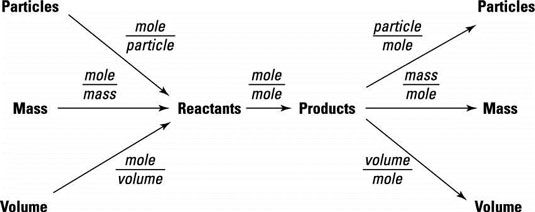
Si nos fijamos en la figura, se puede ver que no es posible convertir directamente entre la masa de una sustancia y la masa de otra sustancia. Debe convertir a moles y luego usar el factor de conversión-topo topo antes de convertir a la masa de una sustancia nueva. Lo mismo puede decirse de las conversiones de las partículas o el volumen de una sustancia a la de otra sustancia. El lunar es siempre el intermediario se utiliza para la conversión.
¿Todos sus cálculos en un problema estequiométrico larga, ahorrando ningún redondeo para el final. Cuando usted tiene una serie de factores de conversión, usted es mucho mejor cálculo de todo en un solo paso en lugar de dividir un problema en múltiples pasos donde se escribe un cálculo en tu calculadora, golpeas entrar, y luego pasar a la siguiente etapa. Haciendo que conduce a un mayor grado de error.
Try un ejemplo: El carbonato de calcio se descompone para producir gas de óxido de calcio y dióxido de carbono sólido de acuerdo con la siguiente reacción.
Suponiendo que 10,0 g de carbonato de calcio se descompone, a responder las dos preguntas siguientes:
¿Cuántos gramos de óxido de calcio se producen?
En primer lugar, convertir 10,0 g de carbonato de calcio a moles de carbonato de calcio mediante el uso de la masa molar de carbonato de calcio (100,09 g / mol) como un factor de conversión. Para determinar los gramos de óxido de calcio producido, debe entonces convertir de moles de carbonato de calcio a moles de óxido de calcio. Tenga en cuenta que se toma el número de moles de conversión topo topo de los coeficientes en la ecuación química balanceada. Entonces convertir de moles de óxido de calcio a gramos de óxido de calcio mediante el uso de la masa molar de óxido de calcio (56.08 g / mol) como un factor de conversión:
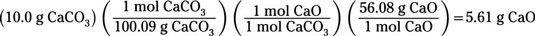
Usted encontrará que se producen 5,61 g de CaO.
A temperatura y presión estándar (STP), ¿cuántos litros de dióxido de carbono se producen?
Para determinar los litros de dióxido de carbono producido, siga la conversión inicial en masa mole con una conversión de topo topo para encontrar los moles de dióxido de carbono producido. Entonces convertir de moles de dióxido de carbono a litros utilizando el hecho de que al STP, cada mol de gas ocupa 22,4 L:
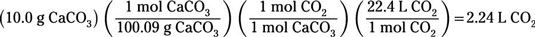
Usted calcula que 2,24 L de CO2 son producidos.
Observe cómo ambos cálculos requieren convertir primero a moles y luego realizar una conversión de topo topo usando estequiometría de la ecuación de la reacción. Luego de convertir a las unidades deseadas. Ambas soluciones se componen de una cadena de factores de conversión, cada factor traer las unidades un paso más cerca de los necesarios en la respuesta.






