¿Cómo trabajar con fracciones molalidad y topo
Al igual que la diferencia en sus nombres, la diferencia práctica entre molaridad y molalidad es sutil. Echa un vistazo de cerca a sus definiciones, expresadas uno junto al otro en las siguientes ecuaciones:
Los numeradores en cálculos molaridad y molalidad son idénticos, pero sus denominadores son muy diferentes. Ofertas molaridad con litros de solución, mientras que ofertas molalidad con kilogramos de disolvente. LA solución es una mezcla de disolvente y un solute- solvente es el medio en el que se mezcla el soluto.
Una complicación adicional a la confusión molaridad / molalidad es cómo distinguir entre sus variables y unidades. Para aclarar esta plétora de m-palabras y sus abreviaturas, echa un vistazo a la tabla.
| Nombre | Variable | Abreviatura Unidad |
|---|---|---|
| Molaridad | M | M |
| Molalidad | m | m |
| Moles | -- | mol |
De vez en cuando, se le puede pedir para calcular el fracción molar de una solución, que es la relación del número de moles de ya sea soluto o solvente en una solución al número total de moles de soluto y disolvente en la solución. Los químicos definen esta cantidad mediante la variable X. Por supuesto, los químicos todavía tienen que distinguir entre las fracciones molares del soluto y el disolvente, que por desgracia tanto comiencen con la letra s.
Para evitar confusiones, se decidió para abreviar soluto y disolvente como A y B, respectivamente, en la fórmula general. En la práctica, las fórmulas químicas del soluto y el disolvente se escriben normalmente como subíndices en lugar de A y B. Por ejemplo, la fracción molar de cloruro de sodio en una solución debería ser escrita como XNaCl.
En general, la relación molar de soluto en una solución se expresa como
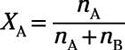
Dónde nLA es el número de moles de soluto y nB es el número de moles de disolvente. La relación molar del disolvente es entonces
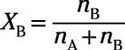
Estas fracciones molares son útiles porque representan la proporción de soluto de la solución y disolvente para solución muy bien y te dan una idea general de qué parte de su solución es soluto y cuánto es solvente.
Aquí'es un ejemplo: ¿Cuántos gramos de sulfuro de dihidrógeno (H2S) le tiene que añadir a 750 g de agua para hacer un 0,35 m solución?
Este problema te da molalidad y la masa de un disolvente y le pide que resuelva para la masa de soluto. Debido molalidad implica lunares y no gramos de soluto, primero tiene que resolver de moles de solvente, y luego utiliza la masa fórmula gramo de cloruro de sodio para resolver el número de gramos de soluto.
Antes de conectar los números en la ecuación molalidad, también se debe señalar que el problema le ha dado la masa del disolvente en gramos, pero la fórmula pide que sea en kilogramos. Pasar de gramos a kilogramos es equivalente a mover el punto decimal tres lugares a la izquierda. El tapar todo lo que sabes en la ecuación para molalidad le ofrece lo siguiente:
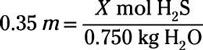
Despejando lo desconocido te da 0.26 mol de H2S en solución. A continuación, deberá multiplicar este valor topo por la masa molecular de H2S para determinar el número de gramos que necesitan ser añadido:
Por lo tanto, necesita 8.9 gramos de sulfuro de dihidrógeno (H2S) para hacer un 0,35 m solución.






