Al ver cómo la ósmosis afecta la química sanguínea
La presión osmótica es un principio químico básico, sino que también desempeña un papel en la biología. De hecho, la ósmosis está pasando en su cuerpo ahora mismo como sus sistemas biológicos trabajan para mantener el equilibrio en la química de su sangre.
Supongamos que usted se tome un recipiente y se divide en dos compartimentos usando una membrana delgada que contiene pores- microscópica de los poros son lo suficientemente grandes para permitir que las moléculas de agua pasen a través de las partículas, pero no de soluto. Este tipo de membrana se llama semyomembrana permeable deja sólo algunas partículas pequeñas pasan a través.
A continuación, añadir una solución de sal se concentró hasta un compartimiento y una solución de sal más diluida a la otra. Inicialmente, los volúmenes de las dos soluciones comienzan a cabo la misma. Pero después de un tiempo, te das cuenta de que el nivel en el lado más concentrados ha aumentado y que el nivel en el lado más diluida se ha reducido. Este cambio en los niveles es debido al paso de moléculas de agua desde el lado más diluida al lado más concentrada a través de la membrana semipermeable. Este proceso se llama osmosis, el paso de un disolvente a través de una membrana semipermeable en una solución de mayor concentración de soluto. La presión que tendría que ejercer sobre el lado más concentrado con el fin de detener este proceso se llama presión osmótica.
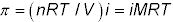
El disolvente siempre fluye a través de la membrana semipermeable desde el lado más diluida a la parte más concentrada. De hecho, usted puede tener agua pura en un lado y cualquier solución de sal en el otro, y el agua siempre va desde el lado de agua pura al lado de sal solución. Cuanto más concentrada la solución de sal, mayor será la presión que se necesita para detener la osmosis (cuanto mayor sea la presión osmótica).
Pero lo que si se aplica más presión que es necesario detener el proceso osmótico, superior a la presión osmótica? El agua es forzada a través de la membrana semipermeable desde el lado más concentrado hacia el lado más diluida en un proceso llamado o invertirsmosis. La ósmosis inversa es una buena manera, relativamente barata de purificar el agua. El mundo tiene muchas plantas de ósmosis inversa que extraen el agua potable del agua de mar. Pilotos de la marina incluso llevan pequeñas unidades de ósmosis inversa con ellos en caso de que tengan para expulsar en el mar.
Las paredes celulares a menudo actúan como membranas semipermeables. ¿Alguna vez se come las salmueras? Los pepinos se sumergen en una solución de salmuera para hacer encurtidos. La concentración de la solución en el interior del pepino es menor que la concentración de la solución de salmuera, para que el agua migra a través de las paredes celulares en la salmuera, haciendo que el pepino se encoja.
Uno de los biológicamente más importantes consecuencias de la presión osmótica implica las células dentro de su propio cuerpo. Por ejemplo, dentro de un glóbulo rojo es una solución acuosa, y fuera de la célula es otra solución acuosa (líquido intercelular). Cuando la solución fuera de la célula tiene la misma presión osmótica que la solución dentro de la célula, se dice que la solución fuera para ser isotónica.
El agua puede ser intercambiado en ambas direcciones, ayudando a mantener la célula sana. Sin embargo, si el fluido intercelular se vuelve más concentrada y tiene una presión osmótica más alta (la solución es hipertónica), El agua fluye principalmente fuera de la célula de la sangre, causando que se encoja y se convierten de forma irregular. Este proceso, llamado crenación, puede ocurrir si la persona se convierte en gravemente deshidratado.
Las células crenada no son tan eficientes en la realización de oxígeno. Si, por otro lado, el fluido intercelular es más diluida que la solución dentro de las células y tiene una presión osmótica más baja (la solución es hipotónica), El agua fluye sobre todo en la célula. Este proceso, llamado hemolysis, hace que la célula se hinche y finalmente romperse.
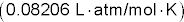
Los procesos de crenación y hemólisis explican por qué la concentración de soluciones IV es tan crítica. Si están demasiado diluidos, a continuación, la hemólisis puede tener lugar, y si son demasiado concentrada, crenación es una posibilidad.
Se puede calcular la presión osmótica (# 960-) mediante la siguiente ecuación:
En esta ecuación, # 960- es la presión osmótica en atmósferas, n es el número de moles de soluto, R es la constante de los gases ideales, T es la temperatura Kelvin, V es el volumen de la solución en litros, y yo es el factor de van't Hoff (el número de moles de partículas que se forma a partir de 1 mol de soluto) - n/V podrá ser sustituido por M, la molaridad de la solución.






