Cómo calcular las presiones parciales utilizando la ley de dalton
Cuando se mezclan los gases, cada gas individual dentro de la mezcla aporta una presión parcial, y la adición de las presiones parciales se obtiene la presión total. Esta relación se resume en Dalton's la ley de las presiones parciales para una mezcla de gases individuales:
Esta relación tiene sentido si se piensa en la presión en términos de la teoría cinética molecular. Adición de una muestra gaseosa en un volumen particular que ya contiene otros gases aumenta el número de partículas en ese espacio. Dado que la presión depende del número de partículas que chocan con las paredes del recipiente, lo que aumenta el número de partículas incrementa la presión proporcionalmente.
No hay una unidad de presión específica que tiene que utilizar cuando se hace problemas con presiones parciales ecuación de Dalton. Mientras las unidades de presión para todos los gases son los mismos, ya está bueno para ir. Sin embargo, si todas las presiones dadas no están en las mismas unidades, a continuación, algunos de conversión debe tener lugar!
Aquí'es un ejemplo: Un químico diseña un experimento para estudiar la química de la atmósfera de la Tierra primitiva. Ella construye un aparato para combinar muestras puras de los gases volcánicos principales que componen la atmósfera miles de millones de años atrás: el dióxido de carbono, amoníaco y vapor de agua. Si las presiones parciales de estos gases son 50 kPa, 80 kPa y 120 kPa, respectivamente, ¿cuál es la presión de la mezcla resultante?
Por difícil química atmosférica temprana Tierra puede llegar a ser, este problema en particular es muy simple. La ley de Dalton establece que la presión total es simplemente la suma de las presiones parciales de los gases componentes:
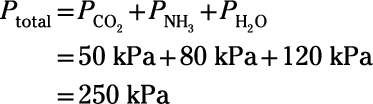
Por lo tanto, la presión de la mezcla resultante es 250 kPa.
Aquí'Es otro problema: Un químico añade polvo de zinc sólido a una solución de ácido clorhídrico para iniciar la reacción siguiente:
El químico invierte un tubo de ensayo y sumerge la boca abierta en el vaso de reacción para recoger el gas de hidrógeno que se propaga hacia arriba de la solución. La reacción procede al equilibrio. Al final del experimento, los niveles de agua dentro del tubo y fuera del tubo son iguales. La presión en el laboratorio es 101,325 kPa, y la temperatura de todos los componentes es 298 K. La presión de vapor de agua a 298 K es 3,17 kPa. ¿Cuál es la presión parcial de gas hidrógeno atrapado en el tubo?
El sistema ha llegado al equilibrio, así que el interior del tubo contiene una mezcla gaseosa de gas de hidrógeno y vapor de agua. Debido a que los niveles de agua dentro y fuera del tubo son iguales, usted sabe que la presión total dentro del tubo es igual a la presión ambiente del laboratorio, 101.325 kPa. La presión total incluye las contribuciones de presión parcial de hidrógeno gaseoso y de vapor de agua. Establecer una ecuación usando la ley de Dalton, reorganizar la ecuación para resolver la presión de tan sólo el gas hidrógeno, conectar los números, y resolver:
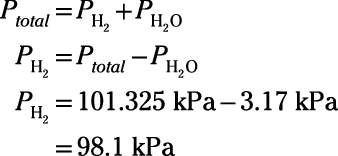
Por lo tanto, la presión parcial de gas hidrógeno atrapado en el tubo es 98,1 kPa.






