Cómo realizar conversiones de topo topo de ecuaciones balanceadas
Usted puede equilibrar una ecuación química mediante el ajuste de los coeficientes que preceden reactivos y productos compuestos dentro de la ecuación. Después de que usted tiene una ecuación equilibrada, puede utilizar los coeficientes de construir factores de conversión topo topo. Este tipo de factores de conversión que te dicen cuánto de cualquier producto determinado se obtiene mediante la reacción de cualquier cantidad dada de reactivo.
Considere la siguiente ecuación balanceada para la generación de amoniaco de los gases de nitrógeno e hidrógeno:
Químicos industriales en todo el mundo llevan a cabo esta reacción, sin humor fijarse en la cantidad de producto amoniaco va a terminar con el al final del día. En cualquier caso, ¿cómo son los químicos para juzgar cómo de cerca sus reacciones se han acercado a la finalización? El corazón de la respuesta está en una ecuación equilibrada y los factores de conversión-topo topo que surgen de ella.
Por cada mol de reactivo de nitrógeno, un químico espera que 2 moles de producto de amoniaco. Del mismo modo, por cada 3 moles de hidrógeno reactivo, el químico espera que 2 moles de producto de amoniaco. Estas expectativas se basan en los coeficientes de la ecuación equilibrada y se expresan como factores de conversión-mol mol como se muestra en la figura.
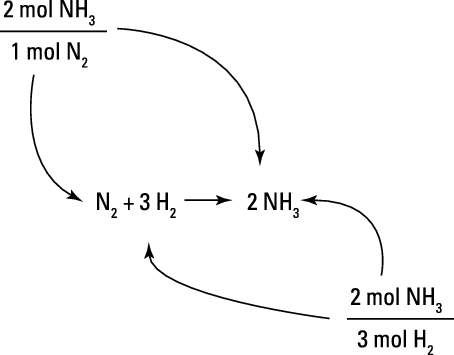
Por ejemplo, digamos que usted desea calcular el número de moles de amoniaco se puede esperar de la reacción de 278 mol de N2 gas.
Para resolver este problema, usted comienza con su cantidad conocida, el 278 mol de nitrógeno que es a reaccionar. Usted multiplica esa cantidad por el factor de conversión-mole mole que se refiere moles de nitrógeno a moles de amoníaco. Usted escribe el factor de conversión para que mol NH3 es en la parte superior y mol N2 está en la parte inferior. De esa manera, la mol N2 unidades se cancelan, dejándole con las unidades deseadas, mol NH3. Los números que usted pone en frente de las unidades para el factor de conversión vienen directamente de los coeficientes de la ecuación química balanceada.

Así, se espera 556 mol de amoníaco de la reacción.
Pruebe con otro ejemplo. Una fuente de gas de hidrógeno es la electrólisis del agua, en el que se hace pasar electricidad a través de agua para romper los enlaces de hidrógeno-oxígeno, produciendo gases de hidrógeno y oxígeno:
Sobre la base de esta ecuación, resolver estos tres problemas:
¿Cuántos moles de resultado gas hidrógeno a partir de la electrólisis del 78,4 moles de agua?
Tenga en cuenta que el número se utiliza para los topos es el coeficiente para el compuesto extraído de la reacción química equilibrada:
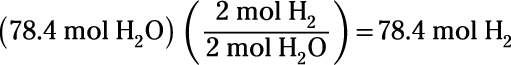
Usted encontrará que la reacción de electrólisis produce 78,4 moles de gas hidrógeno.
¿Cuántos moles de agua son necesarios para producir 905 moles de hidrógeno?
Para encontrar los moles de agua producida, de nuevo aplicar una conversión mol-mol:
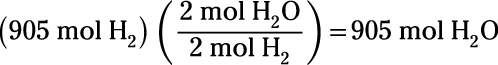
Esto muestra que la reacción produce 905 moles de agua.
Ejecución de la reacción de electrólisis a la inversa constituye la combustión de hidrógeno. ¿Cuántos moles de oxígeno se requiere para quemar 84,6 moles de hidrógeno?
Por último, se ejecuta la reacción de electrólisis inversa:
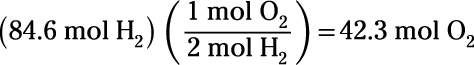
Esto muestra que 42,3 moles de oxígeno son requeridos para quemar 84,6 moles de hidrógeno.






