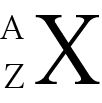En la unión, los átomos pierden, la ganancia, o compartir electrones con el fin de tener el mismo número de electrones como el gas noble que es más cercano en la tabla periódica. Iónicos, covalentes y enlaces metálicos están formados por combinaciones de metales y no metales.
Metal + no metal = enlace iónico
No metal + no metal = enlace covalente
Metal + metal = enlace metálico
Cuando dos elementos se involucran en la unión iónica, uno o más electrones se transfieren desde el metal a la no metal, formando iones (átomos cargados). El metal, después de haber perdido uno o más electrones, forma un catión, un ion positivo con una cargo- el no metal, después de haber ganado uno o más electrones, se convierte en una anión, un ión con una carga negativa.
Cuando dos elementos forman un enlace covalente, uno o más pares de electrones se comparten entre estos dos elementos. En enlace metálico, que se produce en los metales (ya sea un metal puro o una aleación de dos o más metales), la valencia (Shell) exterior electrones son donados a un "mar de electrones".
Conceptos Química: los niveles de energía y Orbitales
Una gran cantidad de la química se explica por el intercambio y el comercio de electrones entre átomos. La comprensión de cómo los electrones se disponen en un átomo es un componente básico de Chem I.
Los electrones en un átomo están contenidos en los niveles de energía específicos (1, 2, 3, y así sucesivamente) que son diferentes distancias del núcleo. Cuanto mayor sea el número del nivel de energía, cuanto más lejos está del núcleo. Los electrones que se encuentran en el nivel de energía más alto se llaman electrones de valencia. Dentro de cada nivel de energía es un volumen de espacio, donde es probable que se ubicará electrones específicos. Estos espacios, llamados orbitales, son de diferentes formas, denotados por una letra (s, p, d, f, g). (En la mayoría de los casos, sólo los electrones contenidos en los s y orbitales p se consideran los electrones de valencia.) Los electrones buscan el nivel de energía más bajo posible.
El siguiente patrón de electrones llenando indica cómo los electrones llenan en los niveles de energía. Conociendo este patrón es útil en muchos aspectos de la química, incluyendo la predicción de la situación de unión de un átomo en particular y en la predicción de la geometría de un compuesto covalente.
Patrón de llenado de electrones: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f
Excavación del concepto de mol en Química
El topo (abreviar mol y, a veces llamado Avogadro'número s) Es un número de conversión que permite a un estudiante químico o química para mover desde el mundo microscópico de los átomos, iones y moléculas para el mundo macroscópico de gramos, kilogramos, y toneladas. El topo se utiliza en estequiometría de la reacción para predecir la cantidad de producto se puede hacer de una cierta cantidad de reactivo reactivo o cuánto se requiere para producir una cierta cantidad de producto.
Si conoces a las partículas, topos, o gramos de una sustancia, se puede calcular las otras dos mediciones utilizando la siguiente ecuación:
1 mol = 6,022 x 1023 partículas / mol = peso de la fórmula expresada en gramos
La identificación de los isótopos través Representaciones
En Chem I, puede que tenga que identificar yosotopes, los cuales son átomos de un mismo elemento que tienen diferente número de neutrones. La siguiente representación le permite identificar un isótopo específico de un elemento. Se utiliza ampliamente en el equilibrio de las reacciones nucleares.
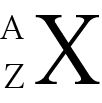
X = símbolo del elemento
Z = número atómico (número de protones)
A = número de masa (número de protones + número de neutrones)
Conversión de Medidas comunes para la Química
Con el fin de tener éxito en su clase Chem I, es necesario tener un firme entendimiento de las mediciones básicas de química y cómo convertirlos de una medición a otra. A continuación se presentan algunas conversiones importantes de temperatura, el tamaño, y la presión, así como prefijos métricos de memorizar para su clase de química:
Conversiones de temperatura:
Ingles / conversiones métricas:
Conversión Presión:
Prefijos métricos comunes:
mili = 0.001
centi- = 0,01
kilo- = 1000
La Química Básica de ácidos y bases
Una gran cantidad de la química requiere que entender la diferencia entre ácidos y bases. Un ácido es una sustancia que dona un H+ iones a otra especie químicas llamadas por placer. LA base es una sustancia que acepta (combina con) un H+ de iones.
Si lo que necesita saber la concentración de la H+ iones en solución, puede hacerlo mediante la representación de la H+ molaridad, [H+]. Otra forma de representar la H+ la concentración es el pH, que es el logaritmo negativo de la H+ molaridad. La siguiente ecuación muestra esta relación matemática, así como la manera de calcular el H+ molaridad dado el pH:
pH = -log [H+] - [H+] = 10-pH
La ley general de los gases y la Ley de los gases ideales
Al estudiar las propiedades de los gases, es necesario conocer las relaciones entre las variables de volumen (V), presión (P), Temperatura Kelvin (T), y la cantidad en moles (n) para que pueda calcular la información que falta (P, V, T, o n) Y resolver problemas estequiometría de la reacción. Aunque los pares de variables tienen relaciones individuales, las dos leyes más importantes y útiles de gas son la ley general de los gases y el ley de los gases ideales:
| Ley general de los gases | (P1V1) /T1= (P2V2) /T2 | (T debe estar en Kelvin) |
| Ley de los gases ideales | PV = nRT | (R = 0,0821 L atm / K.mol) |