Los enlaces covalentes: un ejemplo de hidrógeno
LA enlace covalente
es un enlace químico que proviene de la distribución de uno o más pares de electrones entre dos átomos. El hidrógeno es un ejemplo de un compuesto covalente extremadamente simple.Un ejemplo de hidrógeno
El hidrógeno es el # 1 en la tabla periódica. El hidrógeno encuentra en la naturaleza a menudo no está compuesto de un átomo individual. Se encuentra principalmente como el diatómico (dos átomos) compuesto:
El hidrógeno tiene un electrón de valencia. Se le encantaría ganar otro electrón para llenar su nivel de energía 1s, lo que haría isoelectrónico con helio (porque los dos tendrían la misma configuración electrónica), el gas noble más cercano.
El nivel de energía 1 sólo puede contener dos electrones en el orbital 1s, para la obtención de otro electrón lo llena. Esa es la fuerza motriz de hidrógeno - llenar el nivel de energía de valencia y el logro de la misma disposición de electrones como el gas noble más cercano.
Imagina un átomo de hidrógeno transferir su único electrón a otro átomo de hidrógeno. El átomo de hidrógeno recibir el electrón llena su capa de valencia y alcanza la estabilidad mientras que convertirse en un anión. Sin embargo, el otro átomo de hidrógeno ahora no tiene electrones y se mueve más lejos de la estabilidad.
Este proceso de pérdida de electrones y la ganancia, simplemente no va a suceder, porque la fuerza motriz de los dos átomos es llenar su nivel de energía de valencia. Así que el compuesto de hidrógeno no puede ser el resultado de la pérdida o ganancia de electrones. Qué poder pasar es que los dos átomos pueden compartir sus electrones. A nivel atómico, esta participación está representada por los orbitales electrónicos (a veces llamadas nubes de electrones) se superponen.
Los dos electrones (uno de cada átomo de hidrógeno) " pertenecen " a ambos átomos. Cada átomo de hidrógeno se siente el efecto de los dos electrons- cada uno tiene, en cierto modo, lleno de su nivel de energía de valencia. Se forma un enlace covalente. La superposición de los orbitales electrónicos y el intercambio de un par de electrones está representado en la parte (a) de la siguiente figura.
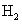
Otra manera de representar este proceso es a través del uso de una fórmula de electrón-punto. En este tipo de fórmula, electrones de valencia se representan como los puntos que rodean el símbolo atómico, y los electrones compartidos se muestran entre los dos átomos que participan en el enlace covalente. La fórmula representaciones electrón-dot se muestran en la parte (b) de la figura anterior.
También puede utilizar una modificación de la fórmula de electrón-punto llamado el Lewis fórmula estructural- es básicamente la misma que la fórmula de electrones punto, pero el par de electrones compartidos (enlace covalente) está representado por un guión. La fórmula estructural Lewis se muestra en la parte (c) de la figura anterior.
Además de hidrógeno, otros seis elementos se encuentran en la naturaleza en forma diatómica: oxígeno, nitrógeno, flúor, cloro, bromo, y yodo.
Comparando enlaces covalentes con otros bonos
El enlace iónico se produce entre un metal y un no metal. El enlace covalente, por otro lado, se produce entre dos elementos no metálicos. Las propiedades de estos dos tipos de compuestos son diferentes. Los compuestos iónicos son generalmente sólidos a temperatura ambiente, mientras que los compuestos unidos covalentemente pueden ser sólidos, líquidos o gases.
Los compuestos iónicos (sales) por lo general tienen un punto de fusión mucho más alto que los compuestos covalentes. Además, los compuestos iónicos tienden a ser electrolitos, y los compuestos covalentes tienden a ser no electrólitos.
Usted puede estar pensando: " Si los metales reaccionan con los elementos no metálicos para formar enlaces iónicos, los no metales y no metales reaccionan con otros para formar enlaces covalentes, hacen metales reaccionan con otros metales "? La respuesta es sí y no.
Metales realmente no reaccionan con otros metales para formar compuestos. En su lugar, los metales se combinan para formar aleaciones, soluciones de un metal en otro. Pero hay una situación como enlace metálico, y está presente en ambas aleaciones y metales puros.
En enlace metálico, los electrones de valencia de cada átomo de metal son donados a una piscina de electrones, comúnmente llamado mar de electrones, y son compartidos por todos los átomos del metal. Estos electrones de valencia son libres de moverse en toda la muestra en lugar de ser fuertemente unido a un núcleo de metal individual. La capacidad de los electrones de valencia a fluir a lo largo de toda la muestra de metal es por qué los metales tienden a ser conductores de la electricidad y del calor.





