Iones: átomos con una carga eléctrica
Los átomos (o grupos de átomos) en las que hay números desiguales de protones y electrones se llaman iones
. Por lo general, el número de protones y electrones en los átomos son iguales. Pero hay casos en los que un átomo puede adquirir una carga eléctrica.Un ejemplo de iones
Por ejemplo, en el compuesto de cloruro de sodio - sal de mesa - el átomo de sodio tiene una carga positiva y el átomo de cloro tiene una carga negativa.
El átomo de sodio neutro tiene 11 protones y 11 electrones, lo que significa que tiene 11 cargas positivas y 11 cargas negativas. En general, el átomo de sodio es neutral, y está representado así: Na. Pero el ión sodio contiene una carga más positiva que la carga negativa, por lo que ha representado así:
Este número desigual de cargas negativas y positivas puede ocurrir en una de dos maneras: Un átomo puede ganar un protón (carga positiva) o perder un electrón (una carga negativa).
Cationes y aniones
Entonces, ¿qué proceso es más probable que ocurra? En general, es fácil que ganar o perder electrones, pero muy difícil de ganar o perder protones. Así que los átomos se convierten en iones por ganar o perder electrones. Y los iones que tienen una carga positiva se denominan cationes.
La progresión es la siguiente: El ión de sodio se muestra arriba se forma a partir de la pérdida de un electrón. Debido a que pierde un electrón, tiene más protones que electrones, o cargos más positivas que las cargas negativas, lo que significa que ahora se llama el:
Del mismo modo, cuando el átomo de magnesio neutral pierde dos electrones, forma el:
Consideremos ahora el átomo de cloro en cloruro de sodio. El átomo de cloro neutro ha adquirido una carga negativa al ganar un electrón. Porque tiene los números desiguales de protones y electrones, es ahora un ion. Y debido a que los iones que tienen una carga negativa se llaman aniones, ahora llama el:
Otros detalles acerca de los iones
Aquí están algunas cositas adicionales sobre los iones:
Usted puede escribir configuraciones electrónicas y diagramas de niveles de energía de iones. El átomo de sodio neutro (11 protones) tiene una configuración electrónica de:
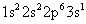
El catión de sodio ha perdido un electrón - electrón de valencia, que es más alejada del núcleo (el electrón 3s, en este caso). La configuración electrónica del ion de sodio es:
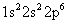
La configuración electrónica del ion cloruro es:
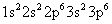
Esta es la misma configuración electrónica como el átomo de argón neutral. Si dos especies químicas tienen la misma configuración electrónica, están dice que es isoelectrónico.
Los ejemplos anteriores son todos los iones monoatómicos (un átomo). Pero sí existen iones poliatómicos (muchos de átomos). El ion amonio es un ión poliatómico, o, específicamente, un catión poliatómico. Está escrito como:
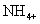
El ion nitrato, también es un ión poliatómico, o, específicamente, un anión poliatómico. Está escrito como
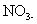
Los iones se encuentran comúnmente en una clase de compuestos llamados sales, o sólidos iónicos. Las sales, cuando se funde o se disuelve en agua, soluciones de rendimiento que conducen la electricidad.
Una sustancia que conduce la electricidad cuando se funde o se disuelve en agua se denomina electrólito. La sal de mesa - cloruro de sodio - es un buen ejemplo.
Por otro lado, cuando se disuelve el azúcar de mesa (sacarosa) en agua, se convierte en una solución que no conduce la electricidad. Así que la sacarosa es un no electrólito.
Si una sustancia es un electrolito o un no electrólito da pistas sobre el tipo de enlace en el compuesto. Si la sustancia es un electrolito, el compuesto se une iónicamente probablemente. Si es un no electrólito, probablemente covalentemente unido.




