Isótopos: diferentes tipos de átomos
Los átomos de un elemento químico que tienen diferente número de neutrones que protones y electrones se llaman isótopos. Los átomos en un elemento particular, tienen un número idéntico de protones y electrones, pero pueden tener un número variable de neutrones.
El hidrógeno es un elemento común en la tierra. El número atómico del hidrógeno es 1 - su núcleo contiene 1 protón. El átomo de hidrógeno también tiene 1 electrón. Debido a que tiene el mismo número de protones como electrones, el átomo de hidrógeno es neutral (las cargas positivas y negativas se anulan entre sí).
La mayoría de los átomos de hidrógeno en la tierra no contienen neutrones. Puede utilizar la simbolización para representar los átomos de hidrógeno que no contienen neutrones, como se muestra en la parte (a) del siguiente diagrama.
Sin embargo, aproximadamente un átomo de hidrógeno de 6000 contiene un neutrón en su núcleo. Estos átomos son todavía de hidrógeno, ya que tiene un protón y un electrón-simplemente tienen un neutrón que la mayoría de los átomos de hidrógeno carecen. Así que estos átomos se llaman los isótopos.
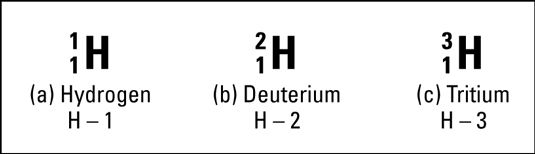
La parte (b) del diagrama muestra un isótopo del hidrógeno, llamado deuterio. Todavía es hidrógeno, ya que contiene sólo un protón, pero es diferente del hidrógeno en la parte (a), ya que también tiene un neutrón. Debido a que contiene un protón y un neutrón, su número de masa es de dos.
Incluso hay un isótopo del hidrógeno que contiene dos neutrones. Éste llama tritio, y está representado en la parte (c) del diagrama. El tritio no se produce de forma natural en la tierra, pero puede ser fácilmente creado.
Observe que el diagrama también muestra una forma alternativa de representar isótopos: Escriba el símbolo del elemento, un guión, y luego el número de masa.
Ahora usted puede preguntarse, " Si estoy haciendo un cálculo de la participación de la masa atómica del hidrógeno, que isótopo Cómo puedo utilizar "? Bueno, se utiliza un promedio de todos los isótopos naturales de hidrógeno. Pero no es un promedio simple.
Hay que tener en cuenta que hay mucho más H-1 a H-2, y que ni siquiera considera H-3, porque no es de origen natural. Se utiliza un promedio ponderado, que tiene en cuenta las abundancias de los isótopos naturales.





