Electronegatividad y unión covalente polar
La electronegatividad es la fuerza tiene un átomo para atraer a un par de electrones de enlace a sí mismo. Cuando un átomo de cloro se une covalentemente a otro átomo de cloro, el par de electrones compartidos se comparte por igual. La densidad de electrones que comprende el enlace covalente se encuentra a medio camino entre los dos átomos.
Pero, ¿qué sucede cuando los dos átomos que participan en un enlace no son lo mismo? Los dos núcleos cargados positivamente tienen diferentes forces- atractiva que " tire " en el par de electrones en diferentes grados. El resultado final es que el par de electrones se desplaza hacia un átomo.
Electrones Atraer: Electronegatividad
Cuanto mayor sea el valor de la electronegatividad, mayor es la fuerza del átomo para atraer a un par de electrones de enlace. La siguiente figura muestra los valores de electronegatividad de los diversos elementos debajo de cada símbolo del elemento en la tabla periódica. Con algunas excepciones, el aumento electronegatividades, de izquierda a derecha, en un período, y la disminución, de arriba a abajo, en una familia.
Electronegatividades dan información acerca de lo que sucederá con la vinculación de los pares de electrones cuando dos átomos de bonos. Un enlace en el que el par de electrones es igualmente compartida se llama enlace covalente no polar. Usted tiene un enlace covalente no polar en cualquier momento los dos átomos que participan en la unión son los mismos o en cualquier momento la diferencia entre las electronegatividades de los átomos involucrados en el vínculo es muy pequeña.
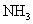
Ahora considere cloruro de hidrógeno (HCl). El hidrógeno tiene una electronegatividad de 2,1, y el cloro tiene una electronegatividad de 3,0. El par de electrones que es la vinculación HCl juntos desplaza hacia el átomo de cloro, ya que tiene un valor de electronegatividad más grande.
Un enlace en el que el par de electrones se desplaza hacia un átomo se denomina enlace covalente polar. El átomo que atrae con más fuerza el par de electrones de unión es ligeramente más negativo, mientras que el otro átomo es ligeramente más positiva. Cuanto mayor sea la diferencia en las electronegatividades, más negativa y positiva los átomos de convertirse.
Ahora mira a un caso en el que los dos átomos tienen muy diferentes electronegatividades - cloruro de sodio (NaCl). El cloruro de sodio se une iónicamente. Un electrón ha transferido a partir de sodio al cloro. El sodio tiene una electronegatividad de 1,0, y el cloro tiene una electronegatividad de 3,0.
Esa es una diferencia de electronegatividad de 2,0 (3,0 a 1,0), lo que hace el enlace entre los dos átomos de muy, muy polares. De hecho, la diferencia de electronegatividad proporciona otra manera de predecir el tipo de vínculo que formará entre dos elementos, tal como se indica en la siguiente tabla.
| Electronegatividad Diferencia | Tipo de enlace formado |
|---|---|
| 0.0 a 0,2 | covalente no polar |
| 0,3 a 1.4 | covalente polar |
| > 1,5 | iónico |
La presencia de un enlace covalente polar en una molécula puede tener algunos efectos bastante dramáticos en las propiedades de una molécula.
Enlace covalente polar
Si los dos átomos que participan en el enlace covalente no son los mismos, el par de unión de los electrones son atraídos hacia un átomo, con ese átomo de tomar en un ligero (parcial) carga negativa y el otro átomo de asumir una carga positiva parcial.
En la mayoría de los casos, la molécula tiene un extremo positivo y un extremo negativo, llamado dipolo (pensar en un imán). La siguiente figura muestra un par de ejemplos de moléculas en las que los dipolos se han formado. (El pequeño símbolo griego por los cargos se refiere a un parcial cargar.)
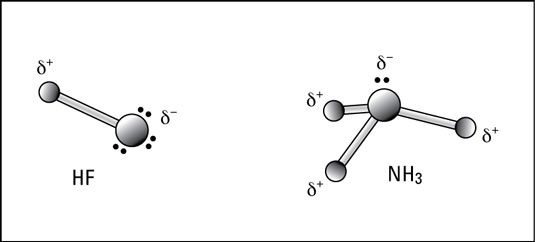
En fluoruro de hidrógeno (HF), el par de electrones de unión se tira mucho más cerca del átomo de flúor que al átomo de hidrógeno, por lo que el extremo de flúor se convierte parcialmente cargada negativamente y el extremo de hidrógeno se carga parcialmente positiva.
Lo mismo tiene lugar en amoníaco, conocido como:
El nitrógeno tiene una electronegatividad mayor que el hidrógeno, por lo que los pares de unión de los electrones se sienten más atraídas a él que a los átomos de hidrógeno. El átomo de nitrógeno adquiere una carga negativa parcial, y los átomos de hidrógeno asumir una carga positiva parcial.
La presencia de un enlace covalente polar explica por qué algunas sustancias actúan de la manera que lo hacen en una reacción química: Debido a que este tipo de molécula tiene un extremo positivo y un extremo negativo, puede atraer a la parte de otra molécula con carga opuesta.
Este tipo de molécula puede actuar como un electrolito débil debido a un enlace covalente polar permite la sustancia para actuar como un conductor. Así que si un químico quiere un material para actuar como un buen aislante (un dispositivo utilizado para conductores separados), el químico buscaría un material con tan débil un enlace covalente polar como sea posible.





