Los enlaces iónicos: por qué y cómo se forman los iones
El enlace iónico es el tipo de enlace que contiene sales juntos. Para entender mejor por qué y cómo iones
Conteúdo
El componentes: sodio y cloro
El proceso de creación de la sal de mesa es bastante notable. Usted toma dos sustancias que son muy peligrosos, y de ellos que realice una sustancia que es necesaria para la vida:
Sodio es un metal alcalino, un miembro de la familia IA en la tabla periódica. Los números romanos en la parte superior de las familias A muestran el número de electrones de valencia (s yp electrones en el nivel de energía más externo) en el elemento en particular. Así sodio tiene 1 electrón de valencia y 11 electrones totales debido a su número atómico es 11.
Cloro es un miembro de la familia de los halógenos - la familia VIIA de la tabla periódica. Cuenta con 7 electrones de valencia y un total de 17 electrones.
Puede utilizar un diagrama de niveles de energía para representar la distribución de los electrones en un átomo. El diagrama de niveles de energía para el sodio y el cloro se muestra en la figura siguiente.
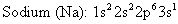
En lugar de utilizar el diagrama de niveles de energía para representar la distribución de los electrones en un átomo, puede utilizar la configuración electrónica. Escribir, por orden, los niveles de energía que se utilizan, los tipos de orbitales (s, p, d, y así sucesivamente), y - en superíndice - el número de electrones en cada orbital.
Aquí están las configuraciones electrónicas para el sodio y el cloro:
La reacción química
Los gases nobles son los elementos VIIIA de la tabla periódica. Son reactivos debido a que su nivel de energía de valencia (nivel de energía más externo) está vacío. El logro de una (completa) el nivel de energía de valencia llena es una fuerza impulsora en la naturaleza en términos de reacciones químicas, porque es cuando se convierten en elementos estables. Ellos no pierden, ganan o comparten electrones.
Los otros elementos en las familias A en la tabla periódica hacen ganancia, perder o compartir electrones de valencia con el fin de llenar su nivel de energía de valencia y convertirse en estable.
Debido a este proceso, en la mayoría de los casos, consiste en llenar los s ultraperiféricas y orbitales p, es a veces llamado el regla del octeto - elementos de ganancia, perder o compartir electrones para alcanzar un octeto completo (8 electrones de valencia: 2 en el orbital s y 6 en el orbital p).
El papel de Sodio
El sodio tiene electrones de valencia por la regla del octeto, se vuelve estable cuando tiene ocho electrones de valencia. Existen dos posibilidades para el sodio se vuelva estable:
Puede ganar siete electrones más para llenar el nivel de energía 3.
Se puede perder un electrón 3s de manera que el nivel de energía 2 (que se obtenga en ocho electrones) se convierte en el nivel de energía de valencia.
En general, la pérdida o ganancia de uno, dos, o, a veces pueden ocurrir incluso tres electrones, sino un elemento no perder o ganar más de tres electrones. Así que para ganar estabilidad, sodio pierde su electrón 3s.
En este punto, tiene 11 protones (11 cargas positivas) y 10 electrones (10 cargas negativas). El átomo de sodio neutro vez ahora tiene una sola carga positiva [11 más (+) 10 (-) es igual a 1+]. Ahora es un ion. Y los iones que tienen una carga positiva (tal como sodio) debido a la pérdida de electrones se denominan catións.
Usted puede escribir una configuración electrónica para el catión de sodio:
El papel de cloro
El cloro tiene siete electrones de valencia. Para obtener su pleno octeto, debe perder los siete electrones en el nivel de energía 3 o ganar uno a ese nivel. Debido a que los elementos no se ganan o pierden más de tres electrones, cloro debe ganar un electrón para llenar nivel de energía 3.
En este punto, el cloro tiene 17 protones (17 cargas positivas) y 18 electrones (18 cargas negativas). Así cloro se convierte en un ión con una sola carga negativa. El átomo de cloro neutro se convierte en el ión cloruro. Los iones con carga negativa debido a la ganancia de electrones se llaman aniones.
La configuración electrónica para el anión cloruro es:
Terminar con un lazo
El sodio puede alcanzar su pleno octeto y estabilidad por la pérdida de un electrón. El cloro puede llenar su octeto al ganar un electrón. Si los dos están en el mismo recipiente, entonces el sodio pierde electrones pueden ser las mismas ganancias de cloro de electrones.
La transferencia de un electrón crea iones - cationes (carga positiva) y aniones (carga negativa) - y las cargas opuestas se atraen entre sí. El catión de sodio atrae el anión de cloro y forma el compuesto NaCl, o sal de mesa.
Este es un ejemplo de una enlace iónico, el cual es un enlace químico (una fuerte fuerza de atracción que mantiene dos elementos químicos juntos) que proviene de la atracción electrostática (atracción de cargas opuestas) entre cationes y aniones.
Los compuestos que tienen enlaces iónicos se denominan comúnmente sales. En cloruro de sodio, se forma un cristal en el que cada catión sodio está rodeado por seis aniones cloruro diferentes, y cada anión cloruro está rodeado por seis diferentes cationes de sodio. La estructura cristalina se muestra en la siguiente figura. Observe la estructura de repetición regular.
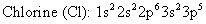
Los diferentes tipos de sales tienen diferentes estructuras cristalinas. Cationes y aniones pueden tener más de una unidad de carga positiva o negativa si ganan o pierden más de un electrón. De esta manera, son posibles muchos tipos diferentes de sales.




