¿Cómo representar los electrones en un diagrama de nivel de energía
Los químicos utilizan a veces un diagrama de niveles de energía para representar los electrones cuando están mirando las reacciones químicas y la vinculación. Un diagrama de niveles de energía es más útil y más fácil de trabajar que los números cuánticos en el modelo mecánico cuántico.
Los químicos utilizan el diagrama de niveles de energía, así como la notación configuración electrónica para representar que el nivel de energía, subnivel y orbital están ocupados por electrones de cualquier átomo en particular. Los químicos utilizan esta información de las siguientes maneras:
Para predecir qué tipo de unión se producirá con un elemento particular y mostrar exactamente qué se están utilizando electrones
Para mostrar por qué ciertos elementos se comportan de manera similar
El siguiente diagrama es un diagrama de nivel de energía en blanco se puede utilizar para representar los electrones de cualquier átomo en particular. No se muestran todos los orbitales y subniveles conocidos. Pero con este diagrama, usted debería ser capaz de hacer casi cualquier cosa que usted necesita.
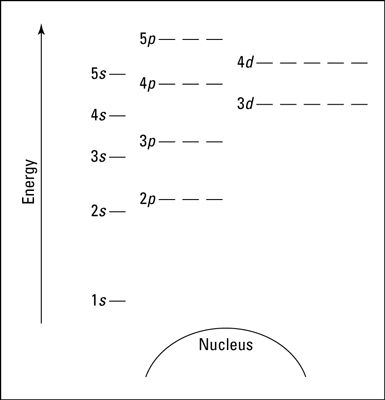
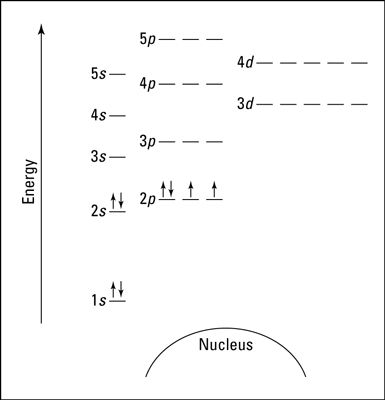
En el diagrama anterior, orbitales se representan con trazos en la que se puede colocar un máximo de dos electrones. El orbital 1s es más cercano al núcleo, y tiene la energía más baja. Es también el único orbital en el nivel de energía 1.
A nivel de energía 2, hay dos s y orbitales p, con los 2s tener energía más bajo que el 2p. Las tres subcapas 2p están representados por tres guiones de la misma energía.
También se muestran los niveles de energía 3, 4, y 5. Observe que el 4S tiene la energía más baja que la 3D: Esta es una excepción a lo que usted pudo haber pensado, pero es lo que se observa en la naturaleza.
El siguiente diagrama muestra el Principio de Aufbau, un método para recordar el orden en el que se llenan los orbitales vacantes los niveles de energía.
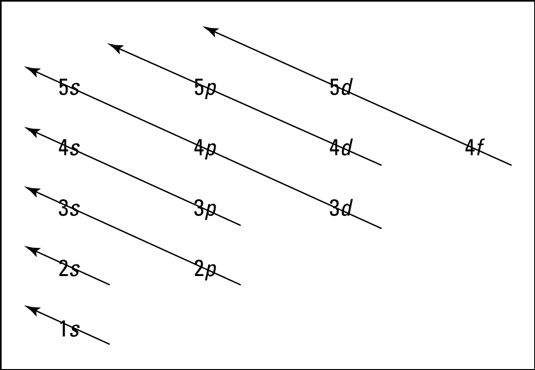
Al utilizar el diagrama de niveles de energía, recuerde dos cosas:
Los electrones llenan los niveles más bajos de energía vacantes primero.
Cuando hay más de un subnivel a un nivel de energía en particular, como en los 3p o 4d niveles, sólo un electrón llena cada subnivel hasta que cada subnivel tiene un electrón. Entonces los electrones comienzan emparejamiento en cada subnivel. Esta regla se llama Regla de Hund.
Suponga que desea dibujar el diagrama de niveles de energía del oxígeno. Te ves en la tabla periódica y encuentra que el oxígeno es el número atómico 8. Este número significa que el oxígeno tiene 8 protones en su núcleo y 8 electrones. Así se pone 8 electrones en su diagrama de niveles de energía.
Puede representar electrones como flechas. Si dos electrones terminan en el mismo orbital, una flecha hacia arriba y el otro hacia abajo.
El primer electrón entra en el orbital 1s, llenando el nivel de energía más bajo primero y el segundo pares de un giro con la primera.
Los electrones 3 y 4 pares de giro en los próximos más vacantes orbitales - los 2s.
Electron 5 entra en una de las 2p subniveles (no importa cuál - todos ellos tienen la misma energía), y los electrones 6 y 7 de entrar en los otros orbitales de dos totalmente vacantes 2p.
Los últimos pares de giro de electrones con uno de los electrones en los subniveles 2p (de nuevo, no importa cuál de ellos lo asocias). El diagrama de nivel de energía completado por el oxígeno aparece en la siguiente ilustración.