Estructura atómica: el modelo de Bohr
Hay dos modelos de estructura atómica en uso hoy en día: el modelo de Bohr y el modelo de la mecánica cuántica. De estos dos modelos, el modelo de Bohr es más simple y relativamente fácil de entender.
Un modelo es útil porque ayuda a entender lo que se observa en la naturaleza. No es raro tener más de un modelo de representar y ayudar a la gente a entender un tema en particular.
¿Alguna vez has comprado cristales de color para su chimenea - hacer llamas de diferentes colores? O ¿alguna vez has visto los fuegos artificiales y se ha preguntado donde los colores vinieron?
Color proviene de diferentes elementos. Si se espolvorea la sal de mesa en un incendio, se obtiene un color amarillo. Las sales que contienen cobre dan una llama de color azul verdoso. Y si nos fijamos en las llamas a través de un espectroscopio, un instrumento que utiliza un prisma para romper la luz en sus diversos componentes, verá una serie de líneas de varios colores. Esas líneas distintas de colores forman un espectro de líneas.
Niels Bohr, un científico danés, explicó este espectro de líneas, mientras que el desarrollo de un modelo para el átomo:
El modelo de Bohr muestra que los electrones en los átomos están en órbitas de diferente energía alrededor del núcleo (piensa en planetas que orbitan alrededor del Sol).
Bohr utilizó el término niveles de energía (o conchas) Para describir estas órbitas de diferente energía. Dijo que la energía de un electrón es cuantificada, significa electrones pueden tener un nivel de energía o de otro, pero nada en el medio.
El nivel de energía de un electrón ocupa normalmente se llama su estado fundamental. Pero puede pasar a una energía superior, nivel menos estable, o cáscara, mediante la absorción de la energía. Esta alta energía, estado menos estable se llama de los electrones estado excitado.
Después se hace siendo excitado, el electrón puede volver a su estado original del terreno por la liberación de la energía que ha absorbido, como se muestra en el siguiente diagrama.
A veces la energía liberada por electrones ocupa la parte de la espectro electromagnético (el rango de longitudes de onda de la energía) que los seres humanos detectan luz visible. Pequeñas variaciones en la cantidad de la energía son vistos como luz de diferentes colores.
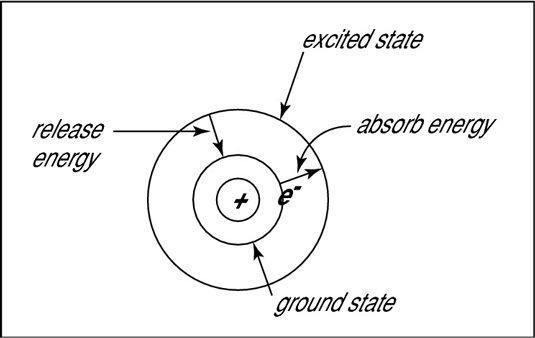 Planta y estados excitados en el modelo de Bohr.
Planta y estados excitados en el modelo de Bohr.
Bohr encontró que cuanto más cerca está un electrón al núcleo, menos energía que necesita, pero cuanto más lejos es, más energía que necesita. Así Bohr numerada niveles de energía del electrón. Cuanto mayor sea el número de niveles de energía, cuanto más lejos está el electrón del núcleo - y cuanto mayor sea la energía.
Bohr también encontró que los diferentes niveles de energía pueden contener diferentes números de electrones: nivel de energía 1 puede contener hasta 2 electrones, nivel de energía 2 puede contener hasta 8 electrones, y así sucesivamente.
El modelo de Bohr funciona bien para los átomos muy simples, tales como el hidrógeno (que tiene 1 de electrones), pero no para los átomos más complejos. Aunque el modelo de Bohr se sigue utilizando hoy en día, sobre todo en los libros de texto de primaria, un más sofisticado (y complejo) modelo - el modelo mecánico cuántico - se utiliza con mucha más frecuencia.




