Estructura atómica: el modelo de la mecánica cuántica
Dos modelos de estructura atómica están en uso hoy en día: el modelo de Bohr y el modelo de la mecánica cuántica. El modelo de la mecánica cuántica se basa en las matemáticas. Aunque es más difícil de entender que el modelo de Bohr, que puede ser utilizado para explicar las observaciones hechas en los átomos de complejos.
Conteúdo
Un modelo es útil porque ayuda a entender lo que se observa en la naturaleza. No es raro tener más de un modelo de representar y ayudar a la gente a entender un tema en particular.
El modelo de la mecánica cuántica se basa en Teoría cuántica, que dice cuestión también tiene propiedades asociadas con olas. De acuerdo con la teoría cuántica, es imposible saber la posición exacta y el momento de un electrón a la vez. Esto se conoce como la Principio de Incertidumbre.
El modelo mecánico cuántico del átomo utiliza formas complejas de orbitales (a veces llamada nubes de electrones), Volúmenes de espacio en el que hay probable ser un electrón. Así, este modelo se basa en la probabilidad en lugar de certeza.
Cuatro números, llamados números cuánticos, se introdujeron para describir las características de los electrones y sus orbitales:
Número cuántico principal n
El momento angular número cuántico: l
Número cuántico magnético:
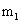
Haga girar número cuántico:
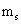
El número cuántico principal
El número cuántico principal n describe la distancia media del orbital del núcleo - y la energía del electrón en un átomo. Puede tener valores enteros positivos (número entero): 1, 2, 3, 4, y así sucesivamente. Cuanto mayor sea el valor de n, mayor es la energía y mayor el orbital. Los químicos llaman a veces los orbitales capas electrónicas.
El número cuántico del momento angular
El número cuántico del momento angular l describe la forma de la orbital, y la forma está limitada por el número cuántico principal n: El número cuántico de momento angular l puede tener valores enteros positivos de 0 a n-1. Por ejemplo, si el valor de n es 3, los tres valores están permitidos para l: 0, 1, y 2.
El valor de l define la forma de la orbital, y el valor de n define el tamaño.
Los orbitales que tienen el mismo valor de n, pero diferentes valores de l son llamados subniveles. Estas subcapas se dan diferentes letras para ayudar a los químicos distinguirlos unos de otros. La siguiente tabla muestra las letras que corresponden a los diferentes valores de l.
| Valor de l (subcapa) | Carta |
|---|---|
| 0 | s |
| 1 | p |
| 2 | d |
| 3 | F |
| 4 | g |
Cuando los químicos describen de un subnivel particular, en un átomo, pueden utilizar tanto el valor ny el subnivel carta - 2p, 3d, y así sucesivamente. Normalmente, un valor subnivel de 4 es el más grande es necesario para describir un subnivel en particular. Si los químicos nunca necesitan un valor mayor, pueden crear números de subshell y letras.
La siguiente figura muestra las formas de las s, p, d orbitales.
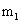
Como se muestra en la fila superior de la figura (a), hay dos orbitales s - uno para el nivel de energía 1 (1s) y el otro para el nivel de energía 2 (2s). Los orbitales s son esféricas con el núcleo en el centro. Observe que el orbital 2s es más grande en diámetro que el orbital 1s. En las grandes átomos, el orbital 1s está enclavado dentro de los 2s, al igual que el 2p está enclavado dentro de la 3p.
La segunda fila de la figura (b) muestra las formas de los orbitales p, y las dos últimas filas (c) muestran las formas de los orbitales d. Observe que las formas se van haciendo progresivamente más compleja.
El número cuántico magnético
El número cuántico magnético se designa como:
Este número se describe cómo los diversos orbitales están orientados en el espacio. El valor de este número depende del valor de l. Los valores permitidos son enteros desde -l a 0 a +l. Por ejemplo, si el valor de l = 1 (orbital p), se puede escribir tres valores para este número: -1, 0 y 1. Esto significa que hay tres subcapas p diferentes para un orbital particular. Los subniveles tienen la misma energía, pero diferentes orientaciones en el espacio.
La segunda fila (b) de la figura muestra cómo los orbitales p se orientan en el espacio. Observe que los tres orbitales p corresponden a los valores de número cuántico magnético de -1, 0, 1 y, orientados a lo largo de los ejes x, y, z.
El número cuántico de espín
El cuarto y último número cuántico es el número cuántico de espín, designado como:
Este número describe la dirección del electrón gira en un campo magnético - en sentido horario o antihorario. Se permiten sólo dos valores: +1/2 o -1/2. Para cada subnivel, no puede haber sólo dos electrones, uno con un giro de +1/2 y otro con un giro de -1/2.






