Cómo determinar las energías permitidas de un átomo de hidrógeno
Cuando se aplica el Schr # 246-dinger ecuación mecánica cuántica para un átomo de hidrógeno, la condición de cuantificación para la función de onda r para permanecer como finito r# 32 va al infinito es
dónde
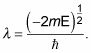
Sustituyendo
en la ecuación de cuantificación condición que dicta la siguiente:
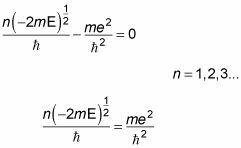
Ahora a resolver por la energía, E. La cuadratura ambos lados de la ecuación anterior le da
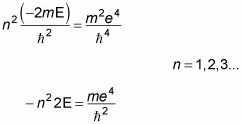
Así que aquí está la energía, E (Nota: Debido a que E depende del número cuántico principal, se cambia el nombre que En):
Los físicos suelen escribir este resultado en términos del radio de Bohr - el radio orbital que Niels Bohr calculó para el electrón en un átomo de hidrógeno, r0. El radio de Bohr es
Y en términos de r0, esto es lo que En es igual a:
El estado de la tierra, donde n = 1, resulta ser sobre E = -13,6 eV.
Tenga en cuenta que esta energía es negativa porque el electrón está en un estado ligado - habría que añadir energía al electrón para liberarlo del átomo de hidrógeno. Éstos son el primer y segundo estados excitados:
En primer estado excitado, n = 2: E = -3.4 eV
En segundo estado excitado, n = 3: E = -1.5 eV
Así que ahora ha utilizado la condición de cuantización, que es
para determinar los niveles de energía del átomo de hidrógeno.






