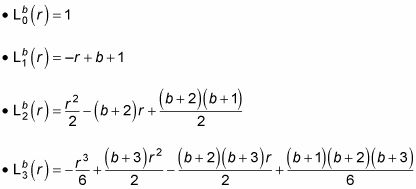Calcula la función de onda de un átomo de hidrógeno utilizando la schr & # ecuación 246-dinger
Si su instructor de la física cuántica te pide encontrar la función de onda de un átomo de hidrógeno, se puede comenzar con el radial Schr # 246-dinger ecuación, Rnl(r), Que le dice que
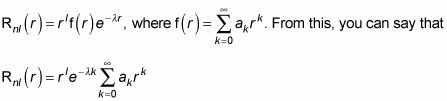
La ecuación anterior proviene de resolver el radial Schr # 246-dinger ecuación:
La solución sólo es bueno para una constante multiplicativa, por lo que añadir una constante, A talesnl (que resulta que dependerá del número cuántico principal n y el número cuántico del momento angular l), Me gusta esto:
A encontrar unnl normalizando Rnl(r).
Ahora tratar de resolver para la Inl(r) Con sólo hacer los cálculos de plano. Por ejemplo, tratar de encontrar R10(r). En este caso, n = 1 y l = 0. Entonces, debido a N + l + 1 = n, usted tiene N = n - l - 1. Así que N = 0 aquí. Eso hace que Rnl(r) se parece a esto:
Y la suma en esta ecuación es igual a
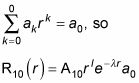
Y por eso l = 0, rl = 1, por lo
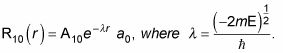
Por lo tanto, usted también puede escribir
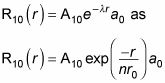
dónde r0 es el radio de Bohr. Para encontrar un10 y la0, a normalizar
a 1, lo que significa la integración
en todo el espacio y el establecimiento el resultado a 1.
y la integración de los armónicos esféricos, tales como Y00, sobre una esfera completa,
le da 1. Por lo tanto, uno se queda con la parte radial de normalizar:
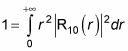
Tapar
dentro
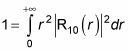
te dio
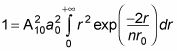
Puede resolver este tipo de una sola pieza con la siguiente relación:
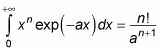
Con esta relación, la ecuación
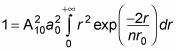
se convierte en
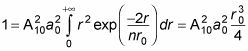
Por Consiguiente,
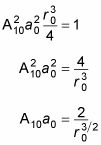
Este es un resultado bastante simple. Porque un10 está ahí para normalizar el resultado, se puede establecer un10 a 1 (esto no sería el caso si
varios términos involucrados). Por Consiguiente,
Eso está bien, y hace R10(r), cual es
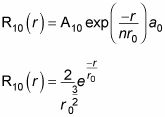
Tu sabes
Y así
se convierte en
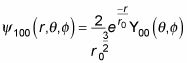
¡Menos mal. En general, esto es lo que la función de onda
parece que para el hidrógeno:
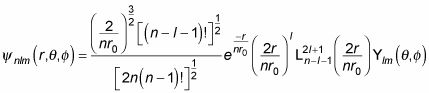
dónde
es un polinomio de Laguerre generalizado. Estos son los primeros polinomios de Laguerre generalizados: