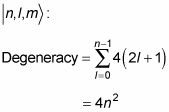Cómo calcular el espín de un electrón en un átomo de hidrógeno
Al calcular el espín de un electrón en un átomo de hidrógeno, es necesario para permitir el giro del electrón, que proporciona estados cuánticos adicionales. Dada la siguiente ecuación, donde la función de onda del átomo de hidrógeno es un producto de partes radiales y angulares,
usted puede añadir una parte de giro, lo que corresponde al spin del electrón, donde s es el spin del electrón y ms es el z componente del giro:
La parte vuelta de la ecuación puede tomar los siguientes valores:
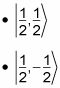
Por lo tanto,
ahora se convierte
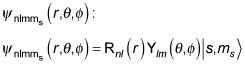
Y esta función de onda puede tomar dos formas diferentes, dependiendo de ms, Me gusta esto:
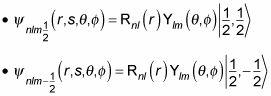
De hecho, puede utilizar la notación de vuelta, donde
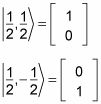
Por ejemplo, para
usted puede escribir la función de onda como
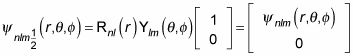
Y para
usted puede escribir la función de onda como
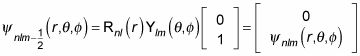
¿Qué hace esto a la degeneración de energía? Si se incluye el espín del electrón, hay dos estados de espín para cada estado
por lo que la degeneración se convierte
Así que si usted incluye espín del electrón, la degeneración de energía del átomo de hidrógeno es 2n2.
De hecho, incluso se puede añadir el espín del protón para la función de onda (aunque la gente no suele hacer eso, porque espín del protón interactúa débilmente con los campos magnéticos aplicados al átomo de hidrógeno). En ese caso, usted tiene una función de onda que se parece a lo siguiente:
dónde se es el spin del electrón, msí es el z componente del espín del electrón, sp es el spin del protón, y msp es el z componente del espín del protón.
Si incluye espín del protón, la función de onda puede ahora tomar cuatro formas diferentes, dependiendo de ms, Me gusta esto:
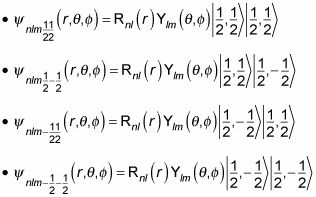
La degeneración ahora debe incluir espín del protón, por lo que es un factor de cuatro para cada