Cómo calcular la degeneración de energía de un átomo de hidrógeno en términos de n, l, m y
Cada estado cuántico del átomo de hidrógeno se especifica con tres números cuánticos: n (el número cuántico principal), l (el número cuántico del momento angular del electrón), y m (el z componente del momento angular del electrón,
¿Cuántos de estos estados tienen la misma energía? En otras palabras, ¿cuál es la degeneración de energía del átomo de hidrógeno en términos de los números cuánticos n, l, y m?
Bueno, la energía real depende sólo en n, como se ve en la siguiente ecuación:
Eso significa que el E es independiente de l y m. Entonces, ¿cuántos estados, |n, l, m>, Tienen la misma energía para un valor particular de n? Bueno, para un valor particular de n, l puede variar desde cero hasta n - 1. Y cada l puede tener diferentes valores de m, por lo que la degeneración total es
La degeneración en m es el número de estados con diferentes valores de m que tienen el mismo valor de l. Para cualquier valor particular de l, puedes tener m valores de -l, -l + 1, ..., 0, ..., l - 1, l. Y eso es (2l + 1) posible m Unidos por un valor particular de l. Así que usted puede conectar (2l + 1) por la degeneración en m:
Y esta serie resulta ser simplemente n2.
Así que la degeneración de los niveles de energía del átomo de hidrógeno es n2. Por ejemplo, el estado fundamental, n = 1, tiene degeneración = n2 = 1 (que tiene sentido porque l, y por lo tanto m, sólo puede ser igual a cero para este estado).
por n = 2, usted tiene una degeneración 4:
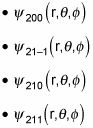
Guay.






