Reglas para la asignación de los números de oxidación de los elementos
Los números de oxidación son números contables. Permiten que los químicos que se pueden hacer cosas como el equilibrio redox (rojoucción /bueydación) ecuaciones. Los números de oxidación son números positivos o negativos, pero no los confunden con cargas positivas o negativas en iones o valencias.
Los números de oxidación se asignan a los elementos que utilizan estas reglas:
Regla 1: El número de oxidación de un elemento en su estado libre (sin combinar) es cero - por ejemplo, Al (s) o Zn (s). Esto también es cierto para los elementos que se encuentran en la naturaleza como diatómico (de dos átomos) elementos
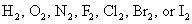
y para el azufre, que se encuentra como:
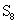
Regla 2: El número de oxidación de un monoatómico ion (un átomo) es la misma que la carga del ion, por ejemplo:
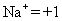
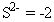
Regla 3: La suma de todos los números de oxidación en un compuesto neutro es cero. La suma de todos los números de oxidación en una poliatómica iones (muchos-átomo) es igual a la carga del ion. Esta regla permite a menudo los químicos para calcular el número de oxidación de un átomo que puede tener múltiples estados de oxidación, si el resto de los átomos en el ion han conocido los números de oxidación.
Regla 4: El número de oxidación de un metal alcalino (familia IA) en un compuesto es 1- + el número de oxidación de un metal alcalinotérreo (familia IIA) en un compuesto es 2.
Regla 5: El número de oxidación del oxígeno en un compuesto es generalmente -2. Si, sin embargo, el oxígeno está en una clase de compuestos llamados peróxidos (por ejemplo, peróxido de hidrógeno), entonces el oxígeno tiene un número de oxidación de -1. Si el oxígeno está unido a flúor, el número es 1.
Regla 6: El estado de oxidación del hidrógeno en un compuesto es por lo general 1. Si el hidrógeno es parte de una hidruro de metal binario (compuesto de hidrógeno y un poco de metal), entonces el estado de oxidación del hidrógeno es -1.
Regla 7: El número de oxidación de flúor siempre es -1. Cloro, bromo, y yodo por lo general tienen un número de oxidación de -1, a menos que estén en combinación con un oxígeno o flúor.
Estas reglas le dan otra manera de definir la oxidación y reducción - en términos de números de oxidación. Por ejemplo, considere esta reacción, lo que demuestra la oxidación por la pérdida de electrones:
Observe que el metal zinc (el reactivo) tiene un número de oxidación de cero (regla 1), y el catión zinc (el producto) tiene un número de oxidación de 2 (regla 2). En general, se puede decir que una sustancia se oxida cuando hay un aumento de su número de oxidación.
Reducción funciona de la misma manera. Considere esta reacción:
El cobre se va a partir de un número de oxidación de 2 a cero. Una sustancia se reduce si hay una disminución en su número de oxidación.






