Células electroquímicas: células linterna
La célula linterna común, una célula electroquímica seca, está contenido en una carcasa de cinc que actúa como el ánodo (el electrodo en el que la oxidación se lleva a cabo). El otro electrodo, el cátodo (donde la reducción se lleva a cabo), es una varilla de grafito en el medio de la célula.
Una capa de óxido de manganeso y negro de carbono (uno de las muchas formas de carbono) rodea la varilla de grafito, y una pasta espesa de cloruro de amonio y cloruro de zinc sirve como electrolito. El diagrama muestra la estructura de una pila seca. Las reacciones de células secas se muestran en la siguiente.
Ánodo reacción / oxidación:
Cátodo reacción / reducción:
Tenga en cuenta que el caso de la pila seca es en realidad uno de los electrodes- se está utilizando en la reacción. Si hay un punto delgado en el caso, podría formar un agujero, y la célula podría escaparse el contenido corrosivos. Además, el cloruro de amonio tiende a corroer la carcasa de metal, de nuevo teniendo en cuenta la posibilidad de fugas.
En la pila seca alcalina (batería alcalina), el cloruro de amonio ácido de la pila seca normal se sustituye por (alcalino) de hidróxido de potasio básico. Con esta sustancia química, la corrosión de la caja de zinc se reduce considerablemente.
Una batería se compone de dos o más células conectadas entre sí. Usted pone una batería en su coche, pero usted pone una célula en su linterna.
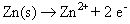
Otra célula con la misma construcción básica es la batería de mercurio pequeña comúnmente utilizado en los relojes, marcapasos, y así sucesivamente. Con esta batería, el ánodo es zinc, como en la pila seca regular, pero el cátodo es de acero. El mercurio (II) óxido (HgO) y un poco de pasta alcalina forman el electrolito.
Usted debe desechar las baterías de mercurio pequeños (como los que se utilizan en relojes) con cuidado, para evitar que el mercurio sea liberado en el medio ambiente.
Todas estas células galvánicas producen electricidad hasta que se queden sin un reactivo. Entonces deben ser descartados. Sin embargo, hay células que pueden ser recargadas, como la reacción redox se puede invertir para regenerar los reactivos originales. Níquel-cadmio (Ni-Cad) y baterías de litio entran en esta categoría. El tipo más familiar de la batería recargable es probablemente la batería del automóvil.




