Células electroquímicas: baterías de automóviles
La batería de automóvil, o acumulador de plomo, se compone de seis celdas electroquímicas conectadas en serie. El ánodo de cada célula es de plomo, mientras que el cátodo es el dióxido de plomo.
Dióxido de plomo se representa como:
Los electrodos se sumergen en una solución de ácido sulfúrico. El ácido sulfúrico se representa como:
Al iniciar su coche, las siguientes reacciones celulares tienen lugar:
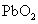
Cuando esta reacción se lleva a cabo, ambos electrodos se recubran de plomo sólido (II) sulfato, y el ácido sulfúrico se utiliza para arriba.
Una vez iniciado el automóvil, el alternador o generador se hace cargo de la tarea de la producción de electricidad (para bujías, luces, etc.) y también recarga la batería. El alternador invierte tanto el flujo de electrones en la batería y las reacciones redox originales, y regenera el plomo y dióxido de plomo:
El acumulador de plomo puede ser descargado y acusado muchas veces. Pero el choque de atropellar a baches en la carretera o en los copos de bordillo de un poco de la (II) sulfato y, finalmente, el plomo provoca que la batería falle.
Durante la carga, la batería del automóvil actúa como un segundo tipo de célula electroquímica, una celda electrolítica, que utiliza electricidad para producir una reacción redox deseado.





