Cómo descifrar las fórmulas de los compuestos iónicos
Cuando se forma un compuesto iónico, el catión y el anión se atraen entre sí, resultando en una sal. Una cosa importante a recordar es que el compuesto debe ser neutral - tienen el mismo número de cargas positivas y negativas.
Poner juntos de magnesio y bromo
Supongamos que usted quiere saber la fórmula, o la composición, del compuesto que resulta de la reacción de magnesio con bromo. Se empieza poniendo el lado dos átomos del otro, con el metal a la izquierda, y luego añadir sus cargos. La siguiente figura muestra este proceso.
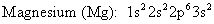
Las configuraciones electrónicas para el magnesio y bromo son:
El magnesio, un metal alcalinotérreo, tiene dos electrones de valencia que pierde para formar un catión con una carga de 2+. La configuración electrónica para el catión magnesio es:
El bromo, un halógeno, tiene siete electrones de valencia, por lo que gana un para completar su octeto (ocho electrones de valencia) y forman el anión bromuro con un cargo 1-. La configuración electrónica para el anión bromuro es
El compuesto debe ser neutro debe tener el mismo número de cargas positivas y negativas de manera que, en general, tiene una carga cero. El ión de magnesio tiene un 2 +, por lo que requiere 2 aniones bromuro, cada uno con una sola carga negativa, para equilibrar las 2 cargas positivas de magnesio. Así que la fórmula del compuesto que resulta de la reacción de magnesio con bromo es:
Usando la regla entrecruzado
Hay una forma rápida de determinar la fórmula de un compuesto iónico: Utilice el entrecruzan regla.
Mira la figura anterior para un ejemplo del uso de esta regla:
Tome el valor numérico de superíndice del ión metálico (olvídate de el símbolo de carga) y moverlo a la parte inferior derecha, lado del símbolo del no metal - como subíndice.
Luego tomar el valor numérico de superíndice del no metal y hacer que el subíndice del metal.
Tenga en cuenta que si el valor numérico es 1, es sólo entendida y no se muestra.
Así que en este ejemplo, se hace de magnesio de 2 subíndice de bromo y hacer de bromo 1 un subíndice de magnesio (sino porque es 1, no demuestras), y se obtiene la fórmula:
Entonces, ¿qué pasa si usted reacciona el aluminio y el oxígeno? La siguiente figura muestra la regla entrecruzado utilizado para esta reacción.
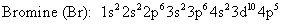
Los compuestos que implican iones poliatómicos funcionan exactamente de la misma manera. Por ejemplo, aquí está compuesto a partir del catión de amonio y el anión sulfuro:
Nótese que debido a que se necesitan dos iones de amonio (dos cargas positivas) para neutralizar las dos cargas negativas del ion sulfuro, el ion amonio se encierra entre paréntesis y un subíndice 2 se añade.
La regla cruzado funciona muy bien, pero hay una situación en la que usted tiene que tener cuidado. Suponga que desea escribir el compuesto que se forma cuando el magnesio reacciona con el oxígeno. El magnesio, un metal alcalinotérreo, forma un catión 2+, y el oxígeno forma un anión 2-. Así que se podría predecir que la fórmula es:
Pero esta fórmula es incorrecta. Después de utilizar la regla entrecruzado, es necesario reducir todos los subíndices por un factor común, si es posible. En este caso, se divide cada subíndice por 2 y obtener la fórmula correcta:
MgO





