Cómo utilizar fórmulas empíricas para encontrar fórmulas moleculares
Muchos compuestos en la naturaleza están compuestos de átomos que se producen en números que son múltiplos de su fórmula empírica. En otras palabras, sus fórmulas empíricas no reflejan el número real de átomos dentro de ellos- en cambio, reflejan sólo las proporciones de esos átomos. Qué fastidio!
Afortunadamente, esta es una vieja molestia, por lo que los químicos han ideado una manera de tratar con él. Para dar cuenta de este tipo de compuestos molestos, los químicos tienen el cuidado de diferenciar entre una fórmula empírica y una fórmula molecular. LA fórmula molecular utiliza subíndices que informan el número real de cada tipo de átomo en una molécula del compuesto (a unidad de fórmula logra lo mismo para los compuestos iónicos).
Fórmulas moleculares están asociados con masas moleculares gram que son múltiplos de números enteros simples de la correspondiente masa fórmula empírica. Por ejemplo, una molécula con la fórmula empírica CH2O tiene una masa fórmula empírica de aproximadamente 30 g / mol (12 para el carbono + 2 para los dos hidrógenos + 16 para el oxígeno). La molécula puede tener una fórmula molecular de CH2O, C2H4O2, C3H6O3, o similares. Como resultado, el compuesto puede tener una masa molecular gramo de 30 g / mol, 60 g / mol, 90 g / mol, u otro múltiplo de 30 g / mol.
No se puede calcular una fórmula molecular basado en el porcentaje de composición solo. Si intenta hacerlo, Avogadro y Perrin se levantarán de sus tumbas, encontrará usted, y usted bofetada 6.02 x 1023 veces por la mejilla. Se puede ver claramente la locura de este enfoque mediante la comparación de formaldehído con glucosa. Los dos compuestos tienen la misma fórmula empírica, CH2O, pero diferentes fórmulas moleculares, CH2O y C6H12O6, respectivamente.
La glucosa es un azúcar simple, la realizada por la fotosíntesis y el roto durante la respiración celular. Usted puede disolverla en su café con resultados agradables. El formaldehído es un componente cancerígeno de smog. Soluciones de formaldehído históricamente se han utilizado para embalsamar cadáveres. La disolución de formaldehído en su café no es aconsejable. En otras palabras, las fórmulas moleculares difieren de fórmulas empíricas, y la diferencia es importante en el mundo real.
Para determinar una fórmula molecular, debe conocer la masa fórmula gramo del compuesto, así como la fórmula empírica (o suficiente información para calcular usted mismo de la composición por ciento). Con estas herramientas en la mano, el cálculo de la fórmula molecular consta de tres pasos:
Calcular la masa fórmula empírica.
Divida la masa molecular gramo por la masa fórmula empírica.
Multiplique cada uno de los subíndices en la fórmula empírica por el número calculado en el Paso 2.
Aquí'es un ejemplo: ¿Cuál es la fórmula molecular de un compuesto que tiene una masa molecular gramo de 34 g / mol y la fórmula empírica HO?
Calcular la masa fórmula empírica.
Usted determina este número mediante la búsqueda de la masa de HO (1 átomo de hidrógeno y 1 átomo de oxígeno).
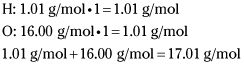
Por lo tanto, la masa fórmula empírica es 17,01 g / mol.
Divida la masa molecular gramo por la masa fórmula empírica.
Dividir la masa molecular gramo por este valor se obtiene la siguiente:
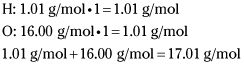
Multiplique cada uno de los subíndices en la fórmula empírica por el número calculado en el Paso 2.
Multiplicando los subíndices dentro de la fórmula empírica por este número le da la fórmula molecular H2O2. Esta fórmula corresponde al compuesto peróxido de hidrógeno.




