Calcular masas moleculares mediante ebullición y de congelación puntos de disolventes
Una sólida comprensión de molalidad le ayuda a calcular los cambios en ebullición y congelación puntos. De la misma manera, una comprensión sólida de elevación del punto de ebullición y congelación punto de la depresión puede ayudar a determinar la masa molecular de un compuesto misterio que se añade a una cantidad conocida de disolvente.
Elevación del punto de ebullición
se refiere a la tendencia de punto de ebullición de un disolvente a aumentar cuando se agrega una impureza (un soluto) a la misma. Depresión del punto de congelación
se refiere a la tendencia de los punto de congelación de un disolvente para disminuir cuando se añade una impureza.
Cuando se le pregunta a resolver los problemas de este tipo, siempre se dará la masa del soluto misterio, la masa de disolvente, y el cambio en el punto de congelación o ebullición o el nuevo punto en sí congelación o ebullición. A partir de esta información, a continuación, sigue una serie de pasos simples para determinar la masa molecular:
Encuentra la elevación del punto de ebullición o depresión del punto de congelación.
Si se te ha dado el punto de ebullición, el cálculo de la
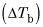
restando el punto de ebullición del disolvente puro a partir del número que se les dio. Si conoce el punto de congelación, restar el punto de congelación del disolvente puro a la misma para obtener el
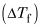
Busque el Kb o KF del disolvente (consulte las tablas después de esta lista).
Resuelve para la molalidad de la solución usando la ecuación para
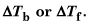
Calcular el número de moles de soluto en la solución multiplicando la molalidad calculado en el paso 3 por el número dado de kilogramos de disolvente.
Divida la masa dada de soluto por el número de moles calculado en el paso 4.
Esta es su masa molecular, o el número de gramos por mol, de la que a menudo se puede adivinar la identidad del compuesto misterio.
| Solvente | Kb en grados C /m | Punto de ebullición en grados C |
|---|---|---|
| Ácido acético | 3.07 | 118.1 |
| Benceno | 2.53 | 80.1 |
| Alcanfor | 5.95 | 204.0 |
| Tetracloruro de carbono | 4.95 | 76.7 |
| Ciclohexano | 2.79 | 80.7 |
| Etanol | 1.19 | 78.4 |
| Fenol | 3.56 | 181.7 |
| Agua | 0,512 | 100.0 |
| Solvente | KF en grados C /m | Punto de congelación en grados C |
|---|---|---|
| Ácido acético | 3.90 | 16.6 |
| Benceno | 5.12 | 5.5 |
| Alcanfor | 37.7 | 179.0 |
| Tetracloruro de carbono | 30.0 | -23.0 |
| Ciclohexano | 20.2 | 6.4 |
| Etanol | 1.99 | -114.6 |
| Fenol | 7.40 | 41.0 |
| Agua | 1.86 | 0.0 |
Aquí'es un ejemplo: Se añadió 97,30 g de un compuesto misterio para 500,0 g de agua, elevando su punto de ebullición a 100.78 grados C. ¿Cuál es la masa molecular del compuesto misterio?
En primer lugar restar el punto de ebullición del agua a partir de este nuevo punto de ebullición:
A continuación, conecte este valor y un Kb de 0.512 en la ecuación para la elevación del punto de ebullición y resuelve para molalidad:
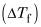
A continuación, tomar este valor molalidad y se multiplica por la masa dada de disolvente, agua, en kilogramos:
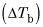
Por último, se divide el número de gramos de soluto misterio por el número de moles, dándole la masa molecular del compuesto:
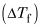
La masa molecular del compuesto es misterio 130 g / mol.






