Cómo elevar y calcular los puntos de ebullición de los disolventes
Elevación del punto de ebullición se refiere a la tendencia de punto de ebullición de un disolvente a aumentar cuando se agrega una impureza (un soluto) a la misma. De hecho, cuanto más soluto que se añade, mayor es el cambio en el punto de ebullición.
Elevaciones de los puntos de ebullición son directamente proporcionales a la molalidad de una solución, pero los químicos han encontrado que algunos disolventes son más susceptibles a este cambio que otros. La fórmula para el cambio en el punto de ebullición de una solución, por lo tanto, contiene una constante de proporcionalidad, abreviado Kb, que es una propiedad determinada experimentalmente y debe ser leído de una mesa como esta.
| Solvente | Kb en grados C /m | Punto de ebullición en grados C |
|---|---|---|
| Ácido acético | 3.07 | 118.1 |
| Benceno | 2.53 | 80.1 |
| Alcanfor | 5.95 | 204.0 |
| Tetracloruro de carbono | 4.95 | 76.7 |
| Ciclohexano | 2.79 | 80.7 |
| Etanol | 1.19 | 78.4 |
| Fenol | 3.56 | 181.7 |
| Agua | 0,512 | 100.0 |
La fórmula para la elevación del punto de ebullición es
dónde m es molalidad. Tenga en cuenta el uso de la letra griega delta en la fórmula para indicar que se está calculando un cambiar en el punto de ebullición, no el propio punto de ebullición. Es necesario añadir este número hasta el punto de ebullición del disolvente puro para obtener el punto de ebullición de la solución. Las unidades de Kb normalmente se dan en grados Celsius por molalidad.
Elevaciones de los puntos de ebullición son el resultado de la atracción entre partículas de disolvente y de soluto en una solución. Propiedades coligativas, tales como elevación del punto de ebullición depende de sólo el número de partículas En solución. Adición de partículas de soluto aumenta estas atracciones intermoleculares debido a que más partículas son alrededor de atraer entre sí. Para hervir, las partículas de disolvente deben por lo tanto lograr una energía cinética mayor para superar esta fuerza de atracción extra, lo que se traduce en un punto de ebullición más alto.
Prueba este ejemplo: ¿Cuál es el punto de una solución que contiene 45,2 g de mentol de ebullición (C10H20O) disuelto en 350 g de ácido acético?
El problema pide el punto de ebullición de la solución, por lo que saber que primero tienes que calcular la elevación del punto de ebullición. Esto significa que usted necesita saber la molalidad de la solución y la Kb valor de la (ácido acético) disolvente. La tabla indica que el Kb de ácido acético es 3,07 grados C /m. Para calcular la molalidad, debe convertir 45.2 g de mentol a moles:

Ahora puede calcular la molalidad de la solución, teniendo cuidado para convertir gramos de ácido acético a kilogramos:
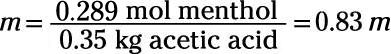
Ahora que tiene molalidad, puede conectarlo y su Kb valorar en la fórmula para encontrar el cambio en el punto de ebullición:
Usted no está muy hecho, porque el problema pide el punto de la solución, no el cambio en el punto de ebullición de ebullición. Por suerte, el último paso es sólo aritmética simple. Usted debe agregar su
hasta el punto de ácido acético puro, el cual, de acuerdo con la tabla, es 118,1 grados Celsius de ebullición. Esto le da un punto de ebullición final de
para la solución.






