¿Cómo se mide la concentración usando solución molaridad y porcentaje
Dos aspectos importantes para medir la concentración son molaridad y solución por ciento. Diferentes solutos se disuelven en diferentes grados en diferentes disolventes en diferentes condiciones. Para realizar un seguimiento de todas estas diferencias, los químicos miden la concentración. Cualitativamente, se dice que una solución con una gran cantidad de soluto para ser se concentró. Una solución con sólo una pequeña cantidad de soluto se dice que es diluir. Cuantitativamente, utilizamos números-, por tanto, molaridad y la solución por ciento.
Molaridad relaciona la cantidad de soluto con el volumen de la solución:
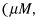
Para calcular la molaridad, puede que tenga que utilizar factores de conversión para moverse entre las unidades. Por ejemplo, si se te da la masa de un soluto en gramos, utilice la masa molar (generalmente redondeado a dos decimales) de ese soluto para convertir la masa dada en los lunares. Si se te da el volumen de solución en mililitros o alguna otra unidad, es necesario convertir ese volumen en litros. Las unidades son lo primero para comprobar si usted consigue un mal problema cuando se utiliza molaridad. Asegúrese de que sus unidades son correctas!
Las unidades de molaridad son siempre moles por litro (mol / L o mol # 183-L-1). Estas unidades son a menudo abreviado como M y en lo sucesivo "molar". Por lo tanto, 0.25 M KOH (aq) Se describe como "Punto dos-5 molar de hidróxido de potasio," y contiene 0,25 moles de KOH por litro de solución. Tenga en cuenta que esto hace no significan que hay 0,25 moles de KOH por litro de solvente (agua, en este caso) - sólo el volumen final de la solución (soluto más disolvente) es importante en la molaridad.
Al igual que otras unidades, la unidad de molaridad puede ser modificado por prefijos estándar, como en milimolar (mM, que es igual a 10-3 mol / L) y micromolar
que es igual a 10-6 mol / L).
Porcentaje solución es otra forma común de expresar la concentración. Las unidades precisas de solución por ciento típicamente dependen de la fase de cada componente. Para los sólidos disueltos en líquidos, porcentaje de masa generalmente se utiliza:
A veces, el término solución por ciento se utiliza para describir la concentración en términos del volumen final de la solución en lugar de la masa final. Por ejemplo:
"5% de Mg (OH)2"Puede significar 5 g hidróxido de magnesio en 100 ml de volumen final. Esta es una solución porcentaje de masa-volumen.
"2% H2O2"Puede significar 2 ml de peróxido de hidrógeno en 100 ml de volumen final. Esta es una solución por ciento en volumen-volumen.
Claramente, prestando atención a unidades es importante cuando se trabaja con la concentración. Sólo mediante la observación de que las unidades están asociadas a una medición se puede determinar si usted está trabajando con molaridad, con porcentaje de masa, o con una masa-volumen, o solución por ciento en volumen-volumen masivo de masas.
Aquí'es un ejemplo: Calcular la molaridad y la solución por ciento de masa-volumen obtenido por disolución de 102,9 g H3Correos4 en 642 ml de volumen final de la solución. Asegúrese de usar unidades apropiadas. (Insinuación: 642 ml = 0,642 L)
En primer lugar, calcular la molaridad. Antes de poder utilizar la fórmula molaridad, sin embargo, usted debe convertir gramos de H3Correos4 a moles:
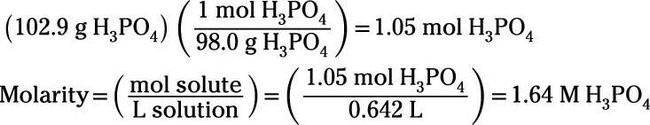
A continuación, el cálculo de la solución por ciento de masa-volumen:
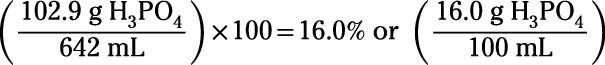
Tenga en cuenta que la convención en molaridad es dividir moles por litros, pero la convención en porcentaje de masa es dividir gramos por mililitros. Si prefiere pensar sólo en términos de litros (no mililitros), a continuación, simplemente considerar ciento de masa en kilogramos dividido por litros.






