Cómo calcular las concentraciones al hacer diluciones
Los químicos de la vida real en los laboratorios de la vida real no hacen todas las soluciones desde cero. En lugar de ello, hacen concentran soluciones madre y luego hacer diluciones de esas poblaciones tan necesarias para un experimento dado.
Para realizar una dilución, sólo tiene que añadir una pequeña cantidad de una solución madre concentrada a una cantidad de disolvente puro. La solución resultante contiene la cantidad de soluto originalmente tomada de la solución madre, pero se dispersa que soluto a lo largo de un mayor volumen. Por lo tanto, la concentración final es lower- la solución final es menos concentrado y más diluida.
¿Cómo saber qué parte de la solución madre de utilizar y la cantidad de disolvente puro a utilizar? Depende de la concentración de la población y de la concentración y el volumen de la solución final que desea. Puede contestar este tipo de preguntas apremiantes utilizando la ecuación de la dilución, que relaciona la concentración (C) y el volumen (V) entre los estados inicial y final:
C1V1 = C2V2
Usted puede utilizar la ecuación de la dilución con cualquier unidad de concentración, siempre y cuando use las mismas unidades en todo el cálculo. Debido a molaridad es de tal manera común de expresar la concentración, la dilución de la ecuación se expresa a veces de la siguiente manera, donde M1 y M2 referirse a la molaridad inicial y final, respectivamente:
M1V1 = M2V2
Por ejemplo, ¿cómo preparar 500. ml de 0.200 M NaOH (aq) A partir de una solución madre de 1,5 M NaOH?
Comience usando la ecuación de la dilución,
M1V1 = M2V2
La molaridad inicial, M1, viene de la solución madre y por lo tanto es de 1,5 M. La molaridad final es el que usted desea en su solución final, que es 0.200 M. El volumen final es el que usted desea para su solución final, 500. ml, lo que equivale a 0.500 L. Usando estos valores conocidos, se puede calcular el volumen inicial, V1:
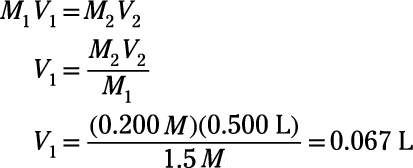
El volumen calculado es equivalente a 67 ml. El volumen final de la solución acuosa es a ser de 500 ml, y 67 ml de este volumen proviene de la solución madre. El resto, 500 ml - 67 ml = 433 ml, proviene de disolvente puro (agua, en este caso). Así que para preparar la solución, agregar 67 ml de 1,5 M solución madre a 433 ml de agua. Mezclar y disfrutar!
Try otro problema: ¿Cuál es la concentración final en molaridad de una solución preparada por dilución de 2,50 ml de 3,00 M KCl (aq) Hasta 0.175 l de volumen final?
Usted puede utilizar la ecuación de la dilución,
M1V1 = M2V2
En este problema, la molaridad inicial es 3,00 M, el volumen inicial es de 2,50 ml o 2,50 x 10-3 L y el volumen final es 0.175 L. Utilice estos valores conocidos para calcular la molaridad final, M2:
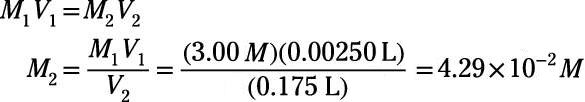
Por lo tanto, la concentración final en molaridad de la solución es
4,29 x 10-2 M






