Cómo calcular la fórmula empírica de un compuesto
Si usted no sabe la fórmula empírica de un compuesto, puede analizar muestras del compuesto desconocido para identificar la composición porcentual. A partir de ahí, a calcular las proporciones de los diferentes tipos de átomos en el compuesto. Expresan estas relaciones como la fórmula empírica.
Una fórmula empírica representa la relación de número entero más bajo de elementos en un compuesto.
Aquí es cómo encontrar una fórmula empírica cuando se administra por ciento composición:
Suponga que tiene 100 g del compuesto desconocido.
La belleza de este pequeño truco es que usted convenientemente regalo a ti mismo con el mismo número de gramos de cada componente elemental como su contribución a la composición por ciento. Por ejemplo, si se supone que tiene 100 g de un compuesto formado por el 60,3% de magnesio y 39,7% de oxígeno, usted sabe que usted tiene 60,3 g de magnesio y 39,7 g de oxígeno. (La única vez que no lo hace es si el problema le da específicamente a las masas de cada elemento presente en el compuesto desconocido.)
Convertir las masas desde el paso 1 en moles utilizando la masa molar.
Determinar qué elemento tiene el valor más pequeño topo. Luego divida todos los valores de mole que calculaste en el Paso 2 por este valor más pequeño.
Esta división da las relaciones molares de los elementos del compuesto.
Si alguno de sus relaciones molares no son números enteros, multiplicar todos los números por el más pequeño posible factor que produce relaciones molares de números enteros para todos los elementos.
Por ejemplo, si usted tiene 1 átomo de nitrógeno por cada 0,5 átomos de oxígeno en un compuesto, la fórmula empírica no es N1O0.5. Tal fórmula sugiere que casualmente un átomo de oxígeno se ha dividido, algo que crearía una explosión nuclear pequeña escala. Aunque suena impresionante, este escenario es casi seguro falsa. Mucho más probable es que los átomos de nitrógeno y oxígeno se combinan en una relación 1: 0,5 proporción pero lo hacen en una proporción más grande pero equivalente de 2: 1. La fórmula empírica es, pues, N2O.
Dado que los datos ciento composición original es típicamente experimental, se espera ver un poco de error en los números. Por ejemplo, 2.03 es probablemente dentro del error experimental de 2, 2,99 es, probablemente, 3, y así sucesivamente.
Escribe la fórmula empírica uniendo estas relaciones molares de números enteros como subíndices a el símbolo químico de cada elemento.
Ordene los elementos de acuerdo a las reglas generales para nombrar compuestos iónicos y moleculares.
He aquí un ejemplo: ¿Cuál es la fórmula empírica de una sustancia que es el 40,0% de carbono, 6,7% de hidrógeno, y el 53,3% de oxígeno en masa?
En aras de la simplicidad, se supone que tiene un total de 100 g de este compuesto misterio. Por lo tanto, usted tiene 40,0 g de carbón, 6,7 g de hidrógeno y 53,3 g de oxígeno. Convertir cada una de estas masas a moles mediante el uso de los gram masas atómicas de C, H y O:
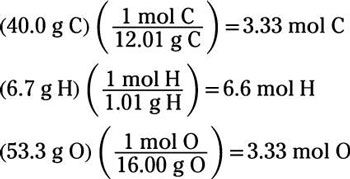
Observe que los números de moles de carbono y oxígeno son los mismos, por lo que saben la relación entre estos dos elementos es de 1: 1 en el compuesto. A continuación, dividir todos los números de moles por el más pequeño de ellos, que es 3,33. Esta división rendimientos
El compuesto tiene la fórmula empírica CH2O. El número real de átomos dentro de cada partícula del compuesto es algún múltiplo de los números expresados en esta fórmula.






