Múltiples bonos en enlace covalente
Cunión ovalent es el intercambio de uno o más pares de electrones. En muchas situaciones enlace covalente, existen múltiples enlaces químicos - más de un par de electrones es compartida. (En hidrógeno y los otros moléculas diatómicas, sólo un par de electrones es compartida.)
El nitrógeno es una molécula diatómica en el Familia VA en la tabla periódica. El nitrógeno tiene cinco electrones de valencia, por lo que necesita tres más electrones de valencia para completar su octeto.
Un átomo de nitrógeno puede llenar su octeto compartiendo tres electrones con otro átomo de nitrógeno, formando tres enlaces covalentes, un denominado triple enlace. La formación de triple enlace de nitrógeno se muestra en la siguiente figura.
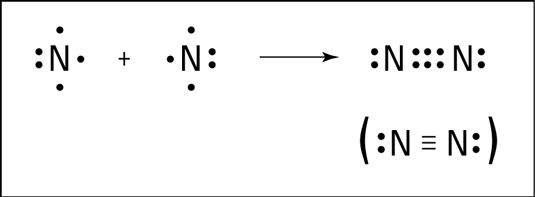
Un triple enlace no es exactamente tres veces más fuerte que un enlace sencillo, pero es un vínculo muy fuerte. De hecho, el triple enlace en nitrógeno es uno de los lazos más fuertes conocidos. Esta unión fuerte es lo que hace de nitrógeno muy estables y resistentes a la reacción con otras sustancias químicas.
Es también por eso que muchos compuestos explosivos (como TNT y nitrato de amonio) contienen nitrógeno. Cuando estos compuestos se rompen en una reacción química, se forma gas nitrógeno, y se libera una gran cantidad de energía.
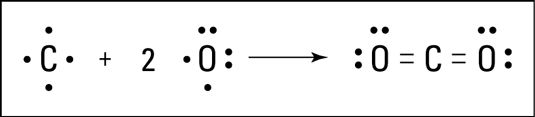
El dióxido de carbono es otro ejemplo de un compuesto que contiene un enlace múltiple. El carbono puede reaccionar con el oxígeno para formar dióxido de carbono. El carbono tiene cuatro electrones de valencia, y el oxígeno tiene seis. El carbono puede compartir dos de sus electrones de valencia con cada uno de los dos átomos de oxígeno, formando dos dobles enlaces. Estos dobles enlaces se muestran en la figura siguiente.