4 Tipos de enlaces químicos
Los átomos tienden a ordenarse en los patrones más estables posibles, lo que significa que tienen una tendencia a completar o llenar sus órbitas de los electrones más externos. Ellos se unen con otros átomos para hacer precisamente eso. La fuerza que mantiene unidos a los átomos en colecciones conocidas como moléculas
que se conoce como una enlace químico. Hay dos tipos principales y algunos tipos secundarios de enlaces químicos: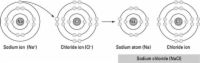
 Agrandar
AgrandarEnlace iónico
Este enlace químico implica una transferencia de un electrón, por lo que las ganancias de un átomo de un electrón, mientras que un átomo pierde un electrón. Uno de los iones resultantes lleva una carga negativa (anión), y el otro ion lleva una carga positiva (cationes). Debido a que las cargas opuestas se atraen, se unen los átomos entre sí para formar una molécula.
 Agrandar
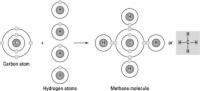
AgrandarEnlace covalente
El vínculo más común en las moléculas orgánicas, un enlace covalente implica el intercambio de electrones entre dos átomos. El par de electrones compartidos forma una nueva órbita que se extiende alrededor de los núcleos de ambos átomos, produciendo una molécula. Hay dos tipos secundarios de enlaces covalentes que son relevantes para la biología - enlaces polares y enlaces de hidrógeno.
 Agrandar
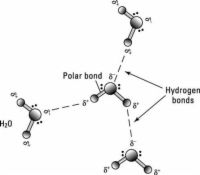
AgrandarEnlace polar
Dos átomos conectados por un enlace covalente pueden ejercer diferentes atracciones para los electrones del enlace, produciendo una carga distribuida de forma desigual. El resultado se conoce como una enlace polar, un caso intermedio entre el enlace iónico y covalente, con un extremo de la molécula cargada negativamente ligeramente y el otro extremo ligeramente cargado positivamente.
Estos ligeros desequilibrios en la distribución de carga se indican en la figura por símbolos delta minúsculas con un superíndice carga (+ o -). Aunque la molécula resultante es neutro, a corta distancia la distribución de carga desigual puede ser importante. El agua es un ejemplo de un molecule- polar final de oxígeno tiene una carga ligeramente positiva mientras que los extremos de hidrógeno son ligeramente negativa. Polaridad explica por qué algunas sustancias se disuelven fácilmente en agua y otros no lo hacen.
Enlace de hidrógeno
Debido a que son polarizados, dos H adyacente2O moléculas (agua) pueden formar un enlace conocido como enlace de hidrógeno, donde el (electronegativo) átomo de hidrógeno de un H2O molécula se electrostáticamente atraído por el (electropositivo) átomo de oxígeno de una molécula de agua adyacente.
En consecuencia, las moléculas de agua se unen de forma transitoria en una red con enlaces de hidrógeno. Los enlaces de hidrógeno tienen sólo alrededor de 1/20 de la fuerza de un enlace covalente, sin embargo, incluso esta fuerza es suficiente para afectar la estructura del agua, la producción de muchas de sus propiedades únicas, tales como la alta tensión de la superficie, el calor específico y calor de vaporización. Los enlaces de hidrógeno son importantes en muchos procesos de la vida, tales como en la replicación y la definición de la forma de moléculas de ADN.




