¿Cómo equilibrar ecuaciones redox
Ecuaciones redox son a menudo tan complejo que jugueteando con coeficientes para balancear ecuaciones químicas no siempre funciona así. Los químicos han desarrollado un método alternativo (además del método del número de oxidación) que se llama ion-electrón método (media-reacción).
En el método de ion-electrón, la ecuación redox desequilibrada se convierte en la ecuación iónica y luego dividirse en dos semirreacciones - oxidación y reducción. Cada uno de estos semirreacciones se equilibra por separado y luego se combinaron para dar la ecuación iónica balanceada.
Finalmente, los iones espectadores se ponen en la ecuación iónica balanceada, la conversión de la reacción de nuevo a la forma molecular. Es importante seguir los pasos de forma precisa y en el orden indicado. De lo contrario, usted no puede tener éxito en el equilibrio de las ecuaciones redox.
El siguiente ejemplo muestra cómo utilizar el método del ion-electrón para equilibrar esta ecuación redox:
Sigue estos pasos:
Convertir la reacción redox desequilibrada a la forma iónica.
En esta reacción, usted demuestra que el ácido nítrico en la forma iónica, porque es un ácido fuerte. De cobre (II) nitrato es soluble (indicado por (aq)), Por lo que ha mostrado en su forma iónica. Debido a que NO (g) y el agua son compuestos moleculares, siguen siendo mostrado en la forma molecular:
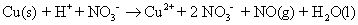
Si es necesario, asignar números de oxidación y luego escribir dos medias reacciones (oxidación y reducción) que muestran las especies químicas que han tenido sus números de oxidación cambiaron.
En algunos casos, es fácil saber lo que se ha oxidado y Reducido pero en otros casos, no es tan fácil. Empieza por ir a través de la reacción de ejemplo y la asignación de números de oxidación. A continuación, puede utilizar las especies químicas que han tenido sus números de oxidación cambiado para escribir sus semirreacciones desequilibradas:
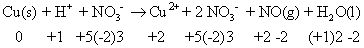
Copper cambiado su número de oxidación (de 0 a 2) y también lo ha de nitrógeno (de -2 a 2). Sus desequilibradas semirreacciones son:
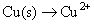
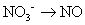
Balance de todos los átomos, con la excepción de oxígeno e hidrógeno.
Es una buena idea esperar hasta el fin de equilibrar los átomos de hidrógeno y oxígeno, por lo que siempre equilibrar los otros átomos primero. Puede equilibrarlos por tocar el violín con los coeficientes. (No se puede cambiar subscripts- sólo puede agregar coeficientes.) Sin embargo, en este caso particular, tanto los átomos de cobre y nitrógeno ya equilibrar, con uno cada uno en ambos lados:
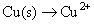
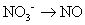
Balance de los átomos de oxígeno.
¿Cómo equilibrar estos átomos depende de si usted está tratando con ácido o soluciones básicas:
En soluciones ácidas, tome el número de átomos de oxígeno necesarios y añadir ese mismo número de moléculas de agua a la parte que necesita oxígeno.
En soluciones básicas, agregue
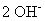
al lado que necesita oxígeno por cada átomo de oxígeno que se necesita. Entonces, al otro lado de la ecuación, añadir la mitad de los moléculas de agua como
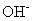
aniones utilizados.
Balance de los átomos de hidrógeno.
Una vez más, el modo de equilibrar estos átomos depende de si usted está tratando con ácido o soluciones básicas:
En soluciones ácidas, tome el número de átomos de hidrógeno necesarios y añadir ese mismo número de
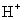
hacia el lado que necesita hidrógeno.
En soluciones básicas, añadir una molécula de agua para el lado que necesita de hidrógeno por cada átomo de hidrógeno que se necesita. Entonces, al otro lado de la ecuación, añadir tantos
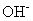
aniones como moléculas de agua utilizados.
Equilibrar la carga iónica en cada media-reacción añadiendo electrones.
Los electrones deben terminar en lados opuestos de la ecuación en las dos medias reacciones. Recuerde que usted está utilizando la carga iónica, no números de oxidación.
Oxidación:
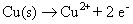
Reducción:
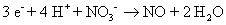
Equilibrar la pérdida de electrones con el aumento de electrones entre los dos semirreacciones.
Los electrones que se pierden en la oxidación media-reacción son los mismos electrones que se obtienen en la reducción media-reacción. El número de electrones perdido y ganado debe ser el mismo. Pero Paso 6 muestra una pérdida de 2 electrones y una ganancia de 3.
Por lo que debe ajustar los números utilizando multiplicadores apropiados tanto para semirreacciones. En este caso, usted tiene que encontrar el mínimo común denominador entre 2 y 3. Es 6, así multiplicar la primera semirreacción por 3 y la segunda semirreacción por 2.
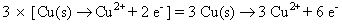
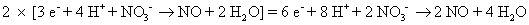
Añadir las dos medias reacciones juntos y cancelar nada común para ambas partes.
Los electrones siempre deben cancelar (el número de electrones debe ser el mismo en ambos lados).
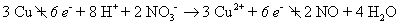
Convertir la ecuación de nuevo a la forma molecular mediante la adición de los iones espectadores.
Si es necesario añadir iones espectadores a un lado de la ecuación, añadir el mismo número al otro lado de la ecuación.
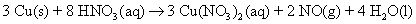
Asegúrese de que todos los átomos están en equilibrio, todas las cargas están equilibradas (si se trabaja con una ecuación iónica al principio), y todos los coeficientes están en la proporción más baja de todo el número.
El ejemplo ecuación está en condiciones ácidas. No hay nada que hacer en la media-reacción que implica el cobre, porque no hay átomos de oxígeno presentes. Pero sí es necesario para equilibrar los átomos de oxígeno en la segunda reacción media:
El ejemplo ecuación está en condiciones ácidas. Usted necesidad de equilibrar los átomos de hidrógeno en la segunda reacción media:
Las reacciones que tienen lugar en la base son igual de fácil, siempre y cuando siga las reglas.





