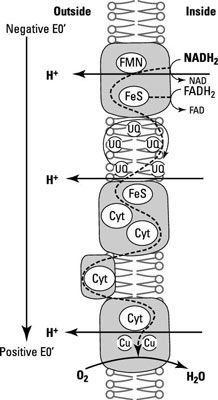
Respiración y electrones portadores
El desglose de los compuestos por los comunicados de respiración mucha más energía que hace el desglose de los mismos compuestos por fermentación. Esto es porque la reducción completa de los productos de fermentación no es posible sin sustitutos de oxígeno o de oxígeno para actuar como aceptores de electrones terminales.
La estrella de este fenómeno es la cadena de transporte de electrones, que implica varios aceptores de electrones posicionado dentro de una membrana con el fin de reducir la potencia de manera que los aceptores de electrones son más débiles en un extremo de la cadena y los aceptores de electrones son más fuertes en el otro extremo. Es la orientación específica de transportadores de electrones en la membrana que crea la fuerza motriz de protones y vincula la síntesis de ATP con él.
La cadena de transporte de electrones reduce los compuestos orgánicos a CO2 y conserva parte de la energía como los electrones se transfieren desde el sustrato de carbono (glucosa), a través de varias reacciones redox al aceptor terminal de electrones (O2).
Algunos portadores unidos a la membrana, como las quinonas, son moléculas no proteicas, pero la mayoría son enzimas de oxidación-reducción y algunos de ellos tienen grupos prostéticos que participan en las reacciones redox. Grupos prostéticos son pequeñas moléculas que se unen de forma permanente a una enzima y son importantes para su actividad.
Los siguientes son muchos transportadores de electrones diferentes que intervienen en la cadena de transporte de electrones:
NADH deshidrogenasas: Estos son proteínas que aceptan un electrón (e-) Y un protón (H+) A partir de NADH, oxidando a NAD+ y pasarlos a una flavoproteína.
Flavoproteínas: Estos se componen de una proteína unida a un grupo prostético llamado flavina, que proviene de la vitamina riboflavina. El grupo flavina acepta dos e- y dos H+ pero sólo dona dos e- cuando se oxida.
Los citocromos: Estas proteínas contienen un grupo prostético hemo con un átomo de hierro en su centro que gana o pierde un solo correo-. Hay diferentes clases de citocromos basado en el tipo de hemo que contienen y marcadas con una letra diferente (por ejemplo, el citocromo a). Cuando la misma clase del citocromo es ligeramente diferente en dos organismos, cada uno obtiene un número adjunto al nombre (por ejemplo, un citocromos1 y un2).
Proteínas hierro-azufre: Estos se unen hierro, pero sin un grupo hemo. En cambio, tienen grupos de azufre y hierro átomos dispuestos en el centro de la proteína. Ellos sólo aceptan correo- y tienen una amplia gama de reducción de la potencia en función del número de átomos de hierro y azufre presentes.
Quiñones: Estas moléculas hidrofóbicas (no proteínas) son libres de moverse alrededor de la membrana. Aceptan de dos e- y dos H+ y suele actuar como un enlace entre las proteínas hierro-azufre y citocromos.
Aquí, usted puede ver ejemplos de algunos de estos compuestos y la forma en que están sentados físicamente dentro de la membrana en el orden correcto para que los electrones fluyen desde el más electronegativo que el más electropositivo.