Química Orgánica 1 libro para los maniquíes
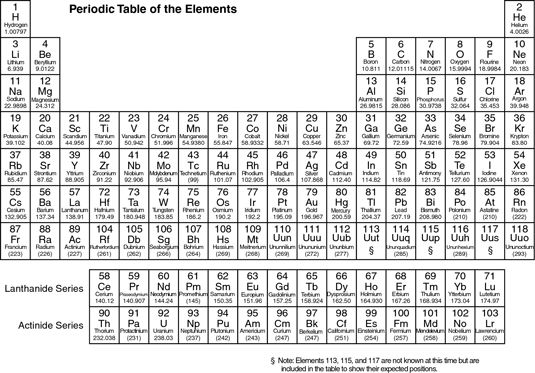
El estudio de los elementos de la tabla periódica es vital para la comprensión de la química orgánica. Así que usted no tiene que memorizar cada elemento, que están agrupados por sus propiedades.
Conceptos importantes de la química orgánica
Cuando usted está estudiando la química orgánica, mantener estos votos recordatorios aledaños, ya que ponen de relieve algunos de los conceptos más importantes que usted necesita para comprender la química orgánica:
Electronegatividad aumenta a medida que avanza hacia arriba y hacia la derecha en la tabla periódica.
En mecanismos de reacción, flechas muestran el movimiento de electrons- la punta de la flecha apunta hacia donde los electrones se van.
Resonancia es una característica de estabilización de la estabilidad molecular moléculas depende generalmente aumenta a medida que el número de estructuras de resonancia aumenta.
Ácidos de Bronsted-Lowry son los donantes de protones bases de Bronsted-Lowry son aceptores de protones.
Los ácidos fuertes tienen débiles (estables) bases conjugadas.
Conformación se refiere a la forma en que una molécula se pliega en el espacio tridimensional basado en la rotación alrededor de configuración bonds- sencillo carbono-carbono (tales como R o S configuración de un centro quiral o configuración cis o trans de dobles enlaces) se refiere a la orientación específica de átomos, que pueden cambiar sólo a través de una reacción química.
Sólo moléculas quirales tienen enantiómeros enantiomers- rotan la luz polarizada en un plano en direcciones iguales y opuestas.
Las moléculas con centros quirales que tiene un plano de simetría se llaman meso compuestos meso compounds- son aquiral.
Para tener diastereómeros, moléculas generalmente tiene que tener dos o más centros quirales.
La mayoría reacciones orgánicas son impulsados por una especie ricos en electrones (un nucleófilo) atacando una especie de electrones pobres (un electrófilo).
Los enlaces dobles se estabilizan por sustituyentes alquilo.
Carbocationes terciarios son más estables que los carbocationes secundarios carbocations- secundarias son más estables que los carbocationes primarios. Carbocationes alílicos y bencílicos carbocationes son tan estables como carbocationes secundarios.
Enlaces triples son más cortos que los enlaces dobles bonds- dobles son más cortos que los enlaces simples.
Electrófilos son ácidos de Lewis (aceptores de electrones) - nucleófilos son bases de Lewis (donadores de electrones).
Las bases débiles son buenas salen de bases fuertes son grupos salientes grupos-malas.
Nucleofilicidad generalmente es paralelo basicidad. Por lo general, bases fuertes también son buenos nucleófilos.
Halogenuros primarios se someten a haluros terciarios SN2 substitution- experimentar sustitución SN1.
Aromáticos tienen compuestos anti-aromáticos electrons- 4n + 2 electrones pi tienen 4n pi.
Los sustituyentes en los anillos aromáticos con pares libres en el átomo de anillo de fijación son directores orto-para.
Sobre el autor
 Conceptos Química: niveles de energía y orbitales
Conceptos Química: niveles de energía y orbitales Una gran cantidad de la química se explica por el intercambio y el comercio de electrones entre átomos. La comprensión de cómo los electrones se disponen en un átomo es un componente básico de Chem I.Los electrones en un átomo están…
 Química para dummies
Química para dummies En la unión, los átomos pierden, la ganancia, o compartir electrones con el fin de tener el mismo número de electrones como el gas noble que es más cercano en la tabla periódica. Iónicos, covalentes y enlaces metálicos están formados por…
 Libro de Química para dummies
Libro de Química para dummies En química, a menudo se utiliza notación exponencial, que es simplemente usando exponentes para expresar un número. Notación cientifica es una forma específica de la notación exponencial que utiliza una potencia de 10 y un número entre 1 y…
 Cómo conjugado estereoquímica del doble enlace funciona en la visión
Cómo conjugado estereoquímica del doble enlace funciona en la visión Para muchos estudiantes de la química orgánica, es fácil llegar a ser empantanado en las minucias de moléculas orgánicas y sus reacciones y se olvidan de que los compuestos orgánicos en realidad forman la columna vertebral de todos los seres…
 Cómo identificar moléculas como compuestos meso
Cómo identificar moléculas como compuestos meso Cualquier molécula que contiene un centro quiral será quiral, con una excepción: un compuesto meso. Un compuesto meso contiene un plano de simetría y por lo tanto es aquiral, independientemente de si la molécula tiene un centro quiral. Un plano…
 Cómo identificar los estereoisómeros de un alqueno
Cómo identificar los estereoisómeros de un alqueno Los alquenos, que son moléculas que contienen dobles enlaces carbono-carbono, tienen la posibilidad de tener estereoisómeros, así como sistemas de anillos hacen. Esto es porque, a diferencia de los enlaces simples carbono-carbono, que son libres…
 Cómo identificar los diastereómeros de una molécula
Cómo identificar los diastereómeros de una molécula Cuando más de un centro quiral está presente en una molécula, tiene la posibilidad de tener estereoisómeros que no son imágenes especulares el uno del otro. Tales estereoisómeros que no son imágenes especulares se denominan…
 Múltiples bonos en enlace covalente
Múltiples bonos en enlace covalente Cunión ovalent es el intercambio de uno o más pares de electrones. En muchas situaciones enlace covalente, existen múltiples enlaces químicos - más de un par de electrones es compartida. (En hidrógeno y los otros moléculas diatómicas, sólo…
 I La química orgánica para dummies
I La química orgánica para dummies En química orgánica, los grupos funcionales (o centros reactivos) son pequeñas unidades estructurales dentro de las moléculas que dictan cómo la mayoría de las reacciones químicas del compuesto ocurren. Conozca estos grupos funcionales…
 La química orgánica ii: los grupos que dirigen los sistemas aromáticos
La química orgánica ii: los grupos que dirigen los sistemas aromáticos En una clase de Química Orgánica II a menudo se agrega grupos de sistemas aromáticos. Si usted se está preguntando donde la sustitución se llevará a cabo, echa un vistazo a esta tabla para algunas directrices. Al utilizar esta tabla, recuerde…
 La química orgánica ii para dummies
La química orgánica ii para dummies Química Orgánica II no tiene que ser tan difícil como usted piensa. Siga estos consejos para estudiar para mejorar su comprensión de la química orgánica, de los bonos átomo de carbono al reacciones sin nombre, y todo lo demás:No se limite a…
 Consejos de estudio para la química orgánica ii
Consejos de estudio para la química orgánica ii Química Orgánica II no tiene que ser tan difícil como usted piensa. Siga estos consejos para estudiar para mejorar su comprensión de la química orgánica, de los bonos átomo de carbono al reacciones sin nombre, y todo lo demás:No se limite a…






