La teoría de cuerdas y el modelo planetario
Hay algunos problemas que permanecen desde el Modelo Estándar, que la teoría de cuerdas espera resolver. Al tratar de averiguar la estructura del átomo, un modelo natural para que los científicos esperan que en el pasado fue el modelo planetario, como se muestra en esta figura. Los electrones se mueven alrededor del núcleo en órbitas.
El físico Niels Bohr determinado que estas órbitas se rigen por las mismas reglas cuánticas que Max Planck había solicitado originalmente en 1900 - que la energía tuvo que ser trasladado en paquetes discretos.
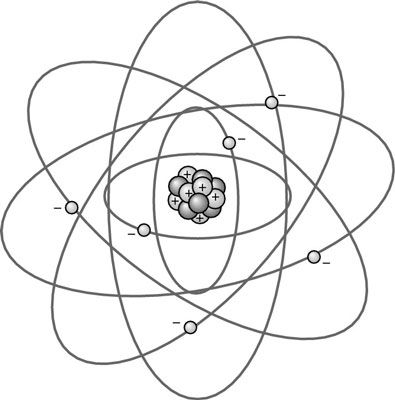
En astronomía, la Tierra y el sol se sienten atraídos el uno al otro por la gravedad, sino porque la Tierra está en movimiento alrededor del Sol, que nunca entran en contacto. Un modelo similar podría explicar por qué las partes negativas y positivas del átomo que nunca entraron en contacto.
El primer modelo planetario fue propuesto en 1904 por el premio Nobel Hantarō Nagaoka. Se basó en los anillos de Saturno y llamó el modelo de Saturno. Ciertos detalles del modelo fueron refutadas por la experimentación, y Nagaoka abandonaron el modelo en 1908, pero Ernest Rutherford revisaron el concepto de crear su propio modelo planetario en 1911, que era más consistente con la evidencia experimental.
Cuando los átomos emiten electrones, la energía del electrón sigue ciertos patrones precisos. Bohr se dio cuenta en 1913 que esto significaba el modelo de Rutherford requiere alguna revisión. Para adaptarse a los patrones, aplicó la idea de que la energía era cuantizada, o agrupados en ciertas cantidades, lo que permitió órbitas estables (en lugar de las órbitas predichas por el colapso de electromagnetismo).
Cada electrón sólo puede existir en un cierto estado de energía, definida con precisión dentro de su órbita. Para pasar de una órbita a otra órbita requerida electrón para tener suficiente energía para saltar de un estado de energía a otro.
Debido a la naturaleza cuántica del sistema, añadiendo la mitad de la cantidad de energía para pasar de una órbita a otra no se movió el electrón a medio camino entre esas órbitas. El electrón se mantuvo en la primera órbita hasta que recibió la suficiente energía para golpearlo con el pie hasta el final en el estado de mayor energía. Esto es aún más de la extraña conducta que haya (con suerte) llegado a esperar de la física cuántica.
El modelo de Rutherford-Bohr funciona bastante bien en la descripción del átomo de hidrógeno, pero a medida que los átomos se vuelven más complejos, el modelo comienza a descomponerse. Sin embargo, los principios básicos son válidas para todos los átomos:
Un núcleo está en el centro de un átomo.
Los electrones se mueven en órbitas alrededor del núcleo.
Las órbitas de los electrones se cuantifican (tienen niveles discretos de energía) y se rigen por las reglas de la física cuántica (aunque se necesitarían varios años para que esas reglas se conviertan desarrollada).





