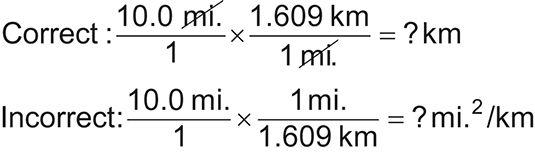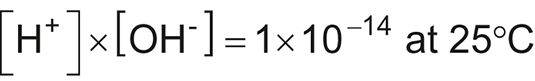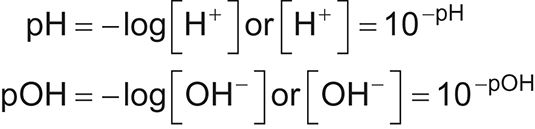Al completar un cálculo química, siempre escribir el número con la unidad. Número, unidad - es como tener un nombre y apellido.
Constantemente escribir las unidades le permite ver lo que anula y le ayuda a detectar un error cuando las unidades no se anulan. Por ejemplo, mira la siguiente conversión de millas a kilómetros. La configuración correcta le da una respuesta en kilómetros. La configuración incorrecta le da una respuesta en millas cuadradas por kilómetro, lo que no tienen sentido.
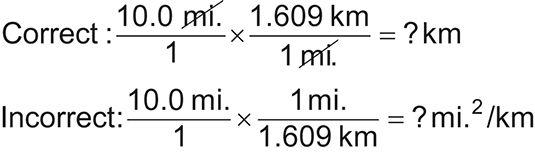
Equilibrio de ecuaciones químicas
Una ecuación química muestra lo que sucede en una reacción química. Como en cualquier ecuación, los elementos en el lado izquierdo de la ecuación (los reactivos) debe ser igual a los elementos de la derecha (los productos). Éstas son sólo algunas cosas que recordar al balancear ecuaciones químicas:
Los mismos elementos en el mismo número: Para una ecuación para equilibrarse, debe tener el mismo número de cada elemento en cada lado de la ecuación. La masa de los reactivos tiene que ser igual a la masa de los productos - recordar la ley de conservación de la masa?
Lo mismo cargo: Si hay una carga neta en un lado de la ecuación, el otro lado de la ecuación debe tener la misma carga.
Fórmulas químicas sin cambios: Lo más importante es no alterar una fórmula química! Los subíndices y superíndices (para el caso) no cambian mágicamente. Cambiar sólo los coeficientes.
Las fórmulas para resolver problemas relacionados con Ácidos y bases
Reacciones ácido-base y sus cálculos asociados desempeñan un papel primordial en muchos sistemas ambientales químicos, biológicos, y. Ya sea que esté determinando la concentración de iones de hidrógeno, [H+] - Concentración de iones hidróxido, [OH# 727-] - PH o pOH, una ecuación y una calculadora son herramientas importantes a tener en su caja de herramientas. A continuación se presentan algunas fórmulas útiles para resolver los problemas de ácido / base.
Cálculo de hidrógeno o concentración de iones hidróxido
La siguiente ecuación le permite calcular la concentración de iones de hidrógeno, [H+], A 25 # 176-C si conoce la concentración de iones hidróxido, [OH-] - También se puede encontrar [OH-] Si sabe [H+]. Sólo dividir 1 x 10-14 por la concentración dado, y se obtiene la concentración que necesita. Consejo: Para utilizar la notación científica en la calculadora, utilice la tecla EE o EXP (seguido por el exponente) en lugar de las teclas x 10 ^.
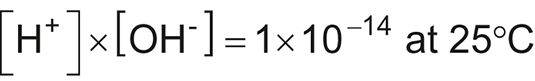
Cálculo de la concentración de iones hidrógeno o hidróxido del pH o pOH
Estar familiarizado con la forma de resolver [H+] O [OH-] Cuando se administra el pH o pOH (o viceversa). Utilice las siguientes fórmulas:
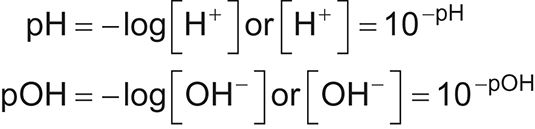
Muchas calculadoras científicas y gráficas difieren en la forma en que manejan la introducción de valores y tomando logaritmos, por lo que saben que el fin de teclas adecuada para su calculadora. Asegúrese de revisar el manual de su calculadora o buscar en línea.
Cálculo de pH cuando se le da el pOH
Cálculo de pH cuando se conoce el pOH (o viceversa) es probablemente el más fácil de los cálculos de ácido-base. Aquí está la fórmula:
pH + pOH = 14
Simplemente reste el valor dado de 14 (mantenimiento de cifras significativas en la mente) para obtener el valor que usted necesita.
Haciendo cálculos de titulación con una relación 1: 1-ácido-base
Cuando te dan los cálculos de valoración en el que el ácido y la base están reaccionando en una proporción de 1: 1 de acuerdo con la ecuación equilibrada, la siguiente ecuación ofrece una manera rápida y fácil de resolver, ya sea para la concentración de una de las sustancias o el volumen necesario para completar la titulación:
MLAVLA M =BVB
Si el ácido y la base no están reaccionando en una proporción de 1: 1, utilice estequiometría (o análisis dimensional) para resolver su cantidad desconocida. Por cierto, estequiometría trabaja para los 1: 1 preguntas de relación, también- sólo se necesita uno o dos pasos más. Recuerda: Mantenga un registro de sus unidades! Cancelar lo que usted necesita para deshacerse de y asegúrese de que usted todavía tiene las unidades que necesita en su respuesta final.
Escribir Configuraciones electrónicas
Un configuración electronica es una descripción de las ubicaciones relativas de los electrones en un átomo o ion. Configuraciones electrónicas se basan principalmente en tres principios: el principio de Aufbau, el principio de exclusión de Pauli, y el principio de incertidumbre de Heisenberg. Lo más importante a recordar es que los electrones llenan los orbitales de energía menor a mayor energía. Piense en un hotel con muchas plantas y un ascensor-rota llegar al piso más alto se lleva la energía - un montón de energía. Los electrones conservar energía para que los orbitales nivel más bajo de energía llenan primero.
Puede utilizar el siguiente diagrama, que se refiere a veces como la regla diagonal, como una ayuda al escribir configuraciones electrónicas. Observe que poner un electrón en un orbital 3d necesita más energía que poner uno en un orbital 4s, porque orbitales 3d son más complejas. Hay otras maneras de recordar el orden en que los orbitales se llenan - usted puede memorizar la secuencia o utilizar una tabla periódica.
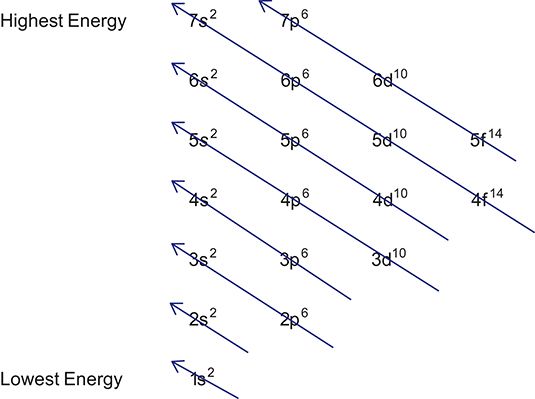
Puede que tenga que escribir una configuración electrónica de un ion en lugar de un átomo. Si tiene que escribir una configuración para un catión (ion positivo), recuerde sustraer el número de electrones igual a la carga a partir del número total de electrones antes de comenzar. Del mismo modo, si usted está escribiendo una configuración para un anión (ion negativo), recuerde añadir el número de electrones igual a la carga con el número total de electrones antes de comenzar.
Configuraciones electrónicas sólo se ponen más difíciles y cuando usted elige los elementos con mayor número de electrones. En general, usted puede revisar su trabajo mediante la suma de todos los exponentes para asegurarse de que tiene el número correcto de electrones. Pero tenga en cuenta que algunos elementos son excepciones a la regla diagonal. Su instructor o un libro deben mencionar estos elementos y le hará saber si usted es responsable de saber escribir sus configuraciones.