El estudio de cinética,
la velocidad de las reacciones químicas, es esencial para el estudio de la química y es un tema importante en cualquier clase de química II. Conocer los conceptos de cinética puede ayudar a su comprensión de por qué algunas reacciones son rápidos y otros lentos y por qué algunas reacciones simples son lentos y otros, las reacciones más complejas son rápidos.
los velocidad de reaccion (la velocidad de la reacción) es el cambio en la concentración de un reactivo o producto por el cambio en el tiempo. Usted puede escribir como:
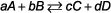
Los químicos normalmente miden concentración en términos de molaridad, M, y el tiempo por lo general se expresa en segundos, s, lo que significa que las unidades de la velocidad de reacción son M / s. Puede expresar el número de unidades de otras maneras, tales como:
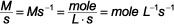
Cómo solucionar problemas de equilibrio homogéneo
los equilibrio constante describe la relación entre las cantidades de los reactivos y los productos a una cierta temperatura. Usted necesita saber la constante de equilibrio, al estudiar Química II. Para el equilibrio general:
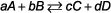
la expresión de la constante de equilibrio es:
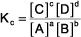
En la expresión, K es la constante de equilibrio, el subíndice c indica que esta constante se expresa en términos de concentraciones (no presiones, p), los soportes (como de costumbre) presentarse a molar (mol / L) la concentración, las mayúsculas son las especies de reactivos y de productos, y los superíndices minúsculas son los coeficientes en la ecuación química balanceada.
Resolución de ácido-base equilibrio Problemas
los ácido y el equilibrio de base constante expresiones describen la relación entre las cantidades de reactivos y productos en los sistemas de ácido-base acuosas. Para el siguiente equilibrio ácido débil-general:
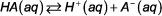
la expresión de la constante de equilibrio es:
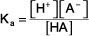
Para un equilibrio débil-base general:
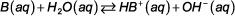
la expresión de la constante de equilibrio es:
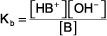
La concentración de agua (o cualquier líquido puro o disolvente o sólido) aparece en la expresión de la constante de equilibrio. K es la constante de equilibrio, el subíndice b indica que esta es una expresión de la constante de equilibrio para una base débil, y los paréntesis indican concentraciones molares.
Cálculo de solubilidad en equilibrio Problemas
los ecuación producto de solubilidad se utiliza para describir la situación de equilibrio cuando una sal no tan soluble se disuelve en agua. Para la disociación general de una sal poco soluble:
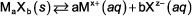
En esta ecuación, X+ y z- son la magnitud de la carga positiva y negativa, respectivamente- la expresión constante de equilibrio (expresión del producto de solubilidad) se
Ksp = [MX+]la[Xz-]b
La lucha contra la termodinámica Problemas
los Energía libre de Gibbs es el mejor indicador de si una reacción será espontánea o no espontánea. Tendrá que saber esto al estudiar Química II. Tiene la forma:
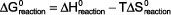
En esta ecuación Delta-G ° es la energía libre de Gibbs de una reacción en condiciones estándar de 1 atm (o 1 bar) para gases y 1 M de soluciones a 25 ° C Delta-H ° es la entalpía de la reacción bajo T condiciones- estándar es el Kelvin con temperatura y Delta-S ° es la entropía de la reacción bajo condiciones estándar.
Un proceso espontáneo tiene ° G lt; 0. Un proceso no espontánea tiene Delta-G> 0. Cuando ° G = 0, el proceso está en equilibrio.






