Cómo temperatura, la concentración, y catalizadores influyen en las tasas de reacción química
Los químicos son quisquillosos, juguetear tipos. Por lo general, quieren cambiar las velocidades de reacción para satisfacer sus propias necesidades. ¿Qué puede afectar las tasas, y por qué? Temperatura, concentración, y catalizadores influyen en las tasas de la siguiente manera:
Las velocidades de reacción tienden a aumentar con la temperatura. Esta tendencia resulta del hecho de que los reactivos deben chocar entre sí para tener la oportunidad de reaccionar. Si reactivos chocan con la orientación correcta y con suficiente energía, se puede producir la reacción. Por lo tanto cuanto mayor sea el número de colisiones y mayor será la energía de esas colisiones, haciendo reaccionar el más real se lleva a cabo. Un aumento de la temperatura corresponde a un aumento de la energía cinética media de las partículas en una mezcla de reacción - las partículas se mueven más rápido, chocando con más frecuencia y con mayor energía.
El aumento de la concentración tiende a aumentar la velocidad de reacción. La razón de esta tendencia también tiene que ver con las colisiones. Una concentración más alta significa que más partículas reaccionantes están más cerca entre sí, por lo que someterse a más colisiones y tienen una mayor posibilidad de reaccionar. El aumento de la concentración de los reactivos puede significar la disolución de más de esos reactivos en solución.
Algunos reactivos no están completamente disueltos, pero vienen en partículas más grandes, sin disolver. En estos casos, las partículas más pequeñas conducen a reacciones más rápidas. Las partículas más pequeñas exponer más área de superficie, por lo que una porción mayor de la partícula disponible para la reacción.
Los catalizadores aumentan las velocidades de reacción. Los catalizadores no se conviertan cambian químicamente, y no alteran la cantidad de producto de una reacción con el tiempo puede producir (el rendimiento). Un ejemplo de la primera infancia se ajusta aquí. Cuando usted está aprendiendo a andar en bicicleta, es posible obtener un empujón de sus padres para ayudar a ponerse en marcha. Sin embargo, después de ese empuje, el pedaleo es totalmente de usted. Su velocidad máxima y el destino final son todavía del todo regulados por su capacidad para pedalear y conducir la moto, pero ese empuje (catalizador) ayudaron a llegar a la velocidad más rápida.
Los catalizadores pueden funcionar de muchas maneras diferentes, pero todas esas formas tienen que ver con la disminución de energía de activación, los reactivos colina energéticos deben subir para llegar a un estado de transición, el estado de mayor energía a lo largo de un camino de reacción. Energías de activación más bajos significan reacciones más rápidas. La figura muestra una diagrama de progreso de la reacción, la vía energética que los reactivos deben atravesar para convertirse en productos.
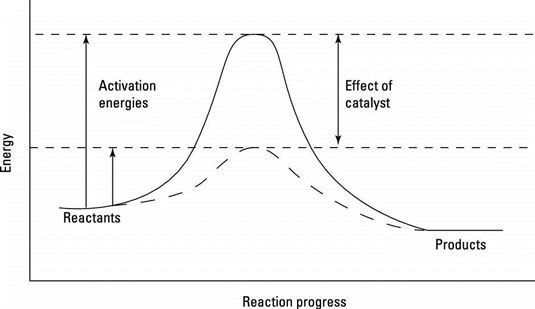 Un diagrama de progreso de la reacción.
Un diagrama de progreso de la reacción.
Como ejemplo, considere la siguiente reacción:
Si 1 mol de H2 reacciona con 1 mol de Cl2 para formar 2 moles de HCl, la reacción no se produce más rápidamente en un recipiente de 5 L o un vaso 10 L? ¿Ocurre con mayor rapidez a 273 K o 293 K? ¿Por qué?
La reacción se produce más rápidamente en el recipiente de 5 L debido a que la concentración de moléculas de reactivo es mayor cuando ocupan el volumen más pequeño. En concentraciones más altas, se producen más colisiones entre moléculas de reactivo. A temperaturas más altas, las partículas se mueven con mayor energía, que también produce más colisiones y las colisiones de mayor fuerza. Entonces el reacción tiene lugar más rápidamente a 293 K.






