La predicción de la presión de gas usando la ley de los gases ideales
En física, se puede utilizar el ley del gas ideal a predecir la presión de un gas ideal si usted sabe la cantidad de gas que tiene, su temperatura, y el volumen que ha encerrado en.
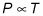
Así es como los diversos factores que influyen en la presión:
La temperatura. Los experimentos demuestran que si se mantiene el volumen constante y calentar un gas, la presión sube linealmente, como se ve en la figura anterior. En otras palabras, a un volumen constante, donde T se mide la temperatura en grados Kelvin y P es la presión, la presión es proporcional a la temperatura:
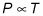
Volumen. Si deja que el volumen varía, también encuentra que la presión es inversamente proporcional al volumen:
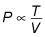
Por ejemplo, si el volumen de un gas se duplica (mientras que la temperatura se mantiene constante), su presión se reduce a la mitad.
Moles. Cuando el volumen y la temperatura de un gas ideal son constantes, la presión es proporcional al número de moles de gas que tiene - dos veces la cantidad de gas, el doble de la presión. Si el número de moles es n, entonces se puede decir lo siguiente:
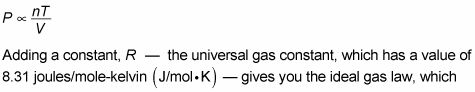
relaciona la presión, volumen, número de moles, y la temperatura:
PV = nRT
La unidad de presión es el pascal y la unidad de volumen es metros3, y se combinan para dar el Joule-cuando la cantidad de gas, n, se mide en moles y la temperatura, T, se mide en grados Kelvin, las unidades de la constante universal de los gases, R, son julios / mol-kelvin
También puede expresar la ley de los gases ideales un poco diferente con el número total de moléculas, N, y el número de Avogadro, NLA:
La constante R/NLA También se llama La constante de Boltzmann, k, y tiene un valor de
El uso de este constante, la ley del gas ideal se convierte
PV = NKT
Digamos que usted está midiendo un volumen de 1 metro cúbico lleno con 600 moles de helio a temperatura ambiente, 27 grados centígrados, lo que está muy cerca de un gas ideal en estas condiciones. ¿Cuál es la presión del gas? El uso de esta forma de la ley de los gases ideales, PV = nRT, puedes poner P por un lado por dividiendo por V. Ahora conecte los números, asegurándose de convertir la temperatura de grados Kelvin:
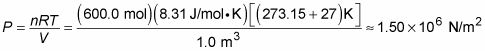
La presión en todas las paredes del recipiente se
Fíjese en las unidades de presión aquí - newtons por metro cuadrado. La unidad se utiliza con tanta frecuencia que tiene su propio nombre en el sistema MKS (metro-kilogramo-segundo): pascales, o PA.
Un Pascal iguala 1 newton por metro cuadrado, o
La presión atmosférica es
que es 14.70 libras por pulgada cuadrada. La presión de 1 atmósfera también se da en torr en ocasiones, y 1,0 atmósfera = 760 torr.
En este ejemplo, usted tiene una presión de
que está a unos 15 atmósferas.





