Cálculo de intercambio de calor en un sistema cerrado
En física, se puede calcular la cantidad de energía calorífica necesaria para elevar un objeto de una cierta masa por una cierta temperatura - todo lo que necesitas es el calor específico del objeto.
A una temperatura dada, los diferentes materiales pueden contener diferentes cantidades de energía térmica. Por ejemplo, si usted calienta una patata, puede celebrar su calor por más tiempo (como la lengua puede dar testimonio) de un material más ligero como el algodón de azúcar. ¿Por qué? Debido a que el almacenes de papa más energía térmica para un cambio dado en con temperatura, por lo tanto, más calor tiene que fluir para enfriar la patata que se necesita para enfriar el algodón de azúcar. La medida de la cantidad de calor que se necesita para elevar la temperatura de un objeto de una masa dada de un determinado número de grados se llama su calor especifico.
Supongamos que usted ve a alguien haciendo una taza de café. Usted mide exactamente 1,0 kilogramo de café preparado en la olla, y luego te pones a las mediciones reales. Te das cuenta de que necesita 4.186 julios de energía de calor para elevar la temperatura del café en 1 grado Celsius, pero necesita sólo 840 julios para recaudar 1,0 kilogramo de vidrio en 1 grado Celsius- el café y el vidrio tienen diferentes calores específicos. La energía de calor entra en la sustancia se calienta, que almacena la energía en forma de energía interna hasta que se filtra de nuevo. (Nota: Si necesita 4.186 julios para recaudar 1,0 kilogramo de café en 1 grado Celsius, necesita el doble, 8.372 julios, para recaudar 2,0 kilogramos de café en 1 grado Celsius o para recaudar 1,0 kilogramo de café por 2 grados Celsius.)
La siguiente ecuación relaciona la cantidad de calor necesaria para elevar la temperatura de un objeto para el cambio en la temperatura y la cantidad de masa que se trate:
Aquí, Q es la cantidad de energía calorífica transferida en el objeto (medida en julios si usted está utilizando el MKS o metro-kilogramo-segundo, del sistema), m es la masa del objeto,
(medido en grados Celsius o Kelvin), y c es una constante llamada calor especifico, que se mide en julios por kilogramo grados centígrados,
Por lo general, los físicos calcular el calor específico a través de la experimentación, por lo que la mayoría de los problemas que se dan c o referirlo a una tabla de valores de calor específico para diversos materiales.
Puede utilizar la ecuación del calor para averiguar cómo los cambios de temperatura cuando se mezclan líquidos de diferentes temperaturas. Suponga que tiene 45 gramos de café en su taza, pero se enfría mientras estabas averiguar calor específico del café. Usted llama por encima de su anfitrión. El café es de 45 grados centígrados, pero que les guste a los 65 grados centígrados. El anfitrión se levanta para verter un poco más. " Un momento, " tu dices. " El café en el bote es de 95 grados centígrados. Espere hasta que calculo exactamente cuánto necesita para verter ".
La siguiente ecuación representa el calor perdido por la nueva masa de café, m1:
Y aquí está el calor ganado por el café, la masa existente m2:
Asumiendo que tiene una taza de café superinsulating, no hay energía deja el sistema hacia el exterior, y porque la energía no se crea ni se destruye, la energía se conserva dentro de un sistema- tan cerrada, por lo tanto, la pérdida de calor por el nuevo café es el calor que el vigente ganancias de café, por lo
Por lo tanto, se puede decir lo siguiente:
cm1(T - T1,0) = -cm2(T - T2,0)
Dividiendo ambos lados por el calor específico del café, c, y enchufar los números que da el siguiente:
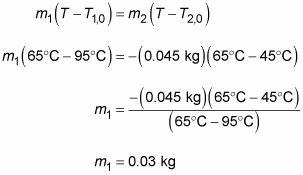
Necesitas 0.03 kilogramos, o 30 gramos. Satisfecho, se pone lejos su calculadora y dices: " Dame exactamente 30 gramos de ese café ".






